疾病详情
定义COPD(如图1)是一种具有气流受限特征的可以预防和治疗的疾病,气流受限不完全可逆、呈进行性发展,与肺部对香烟、烟雾等有害气体或有害颗粒的异常炎症反应有关。COPD主要累及肺,但也可引起全身(或称肺外)的不良效应。
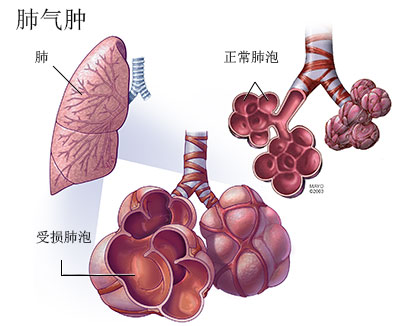
图1 肺气肿
肺功能检查对确定气流受限有重要意义。在吸入支气管舒张剂后,一秒钟用力呼气容积(FEV1)/用力肺活量(FVC)<70%表明存在气流受限,并且不能完全逆转。慢性咳嗽、咳痰常先于气流受限许多年存在;但不是所有有咳嗽、咳痰症状的患者均会发展为COPD。部分患者可仅有不可逆气流受限改变而无慢性咳嗽、咳痰的症状。
COPD与慢性支气管炎和肺气肿密切相关,多数患者是由慢性支气管炎和肺气肿发展而来。通常,慢性支气管炎是指在除外慢性咳嗽的其他已知原因后,患者每年咳嗽、咳痰3个月以上,并持续2年者。肺气肿则指肺部终末细支气管远端气腔出现异常持久的扩张,并伴有肺泡壁和细支气管的破坏而无明显的肺纤维化。当慢性支气管炎、肺气肿患者肺功能检查出现气流受限并且不能完全可逆时,则诊断为COPD。如患者只有“慢性支气管炎”和(或)“肺气肿”,而无气流受限,则不能诊断为COPD。可将具有咳嗽、咳痰症状的慢性支气管炎视为COPD的高危者。
支气管哮喘及一些已知病因或具有特征病理表现的气流受限疾病,如支气管扩张症、肺结核纤维化病变、肺囊性纤维化、弥漫性泛细支气管炎以及闭塞性细支气管炎等,均不属于COPD。
危险因素COPD的主要危险因素包括遗传与环境两个方面。比如同样吸烟的人,只有其中一些人发展为COPD,这是由于遗传易感性不同所致。
基因 COPD是一种多基因疾病,已知的遗传因素为α1-抗胰蛋白酶缺乏。α1-抗胰蛋白酶是一种主要的血循环中蛋白酶的抑制剂。重度α1-抗胰蛋白酶缺乏与非吸烟者的肺气肿形成有关。在我国α1-抗胰蛋白酶缺乏引起的肺气肿迄今尚未见正式报道。在患有严重COPD的吸烟同胞中,已观察到气流阻塞具有显著的家族性风险,这提示遗传因素可能影响对本病的易感性。通过对遗传血统分析,已证实基因组中有数个区域可能含有COPD易感基因,包括染色体2q。遗传相关性研究已涉及COPD发病中一系列基因,包括转移生长因子β1(TGF-β1),微粒环氧化物水解酶1(MEPHX1),肿瘤坏死因子α(TNFα)。然而,这些遗传相关性研究的结果还很不一致,且影响COPD发病的功能性基因变异(除外α1-抗胰蛋白酶缺乏)还没有被明确证实。
环境因素由于个体一生中可能暴露于一系列不同类型的可吸入颗粒,各种颗粒根据其大小和成分,致病风险各不同,总的风险取决于暴露的浓度和时间。烟草烟雾、职业性粉尘及化学物质(蒸汽、刺激剂、烟雾)是已知的可导致COPD的危险因素。
1.吸烟 吸烟是目前最常见的导致COPD的危险因素。与非吸烟者相比,吸烟者出现呼吸道症状和肺功能异常的概率更高,每年FEV1下降的速度更快,COPD的死亡率更高。但并非所有的吸烟者均会发展成具有显著临床症状的COPD,这提示遗传因素必定影响个体的患病风险。被动吸烟也会致使出现呼吸道症状和COPD,这是由于增加了肺的可吸入颗粒和气体负担所致。怀孕期间吸烟,可能会影响宫内胎儿肺的生长发育及免疫系统的形成,进而使胎儿面临日后患病的风险。
2.职业粉尘与化学物质 当职业性粉尘及化学物质(烟雾、过敏原、有机与无机粉尘、化学物质)的浓度过大或接触时间过久,均可导致与吸烟无关的COPD发生。
3.室内空气污染 木材、动物粪便、农作物残梗、煤炭,以及明火在通风功能不佳的火炉中燃烧,均可导致严重的室内空气污染,是导致COPD的一个很重要的危险因素。
4.室外空气污染 城镇严重的空气污染对已有心肺疾病的个体很有害。城市中因燃烧石油造成的空气污染,主要源于机动车辆排放的尾气,与呼吸功能下降有关。然而,室外空气污染在COPD致病中的地位尚不明确。
肺的生长与发育 肺的生长与妊娠、出生及童年时暴露史等有关。肺功能的最大测定值降低(通过肺功能仪测定),可识别出那些具有发展成为COPD的高危人群。在妊娠及童年时期,任何可影响肺生长的因素均具有潜在增加个体发生COPD的风险。
感染社会经济状态发生COPD的风险与社会经济状态呈负相关。这可能与低社会经济状态与暴露于室内及室外空气污染物、居室拥挤、营养状态差或其他因素有关。
发病机制香烟、烟雾等慢性刺激物作用于气道,使气道发生异常炎症反应。氧化与抗氧化失衡和肺部的蛋白酶和抗蛋白酶失衡进一步加重COPD肺组织炎症,遗传因素可能参与其中。这些机制共同促进了COPD的发生(图1)。
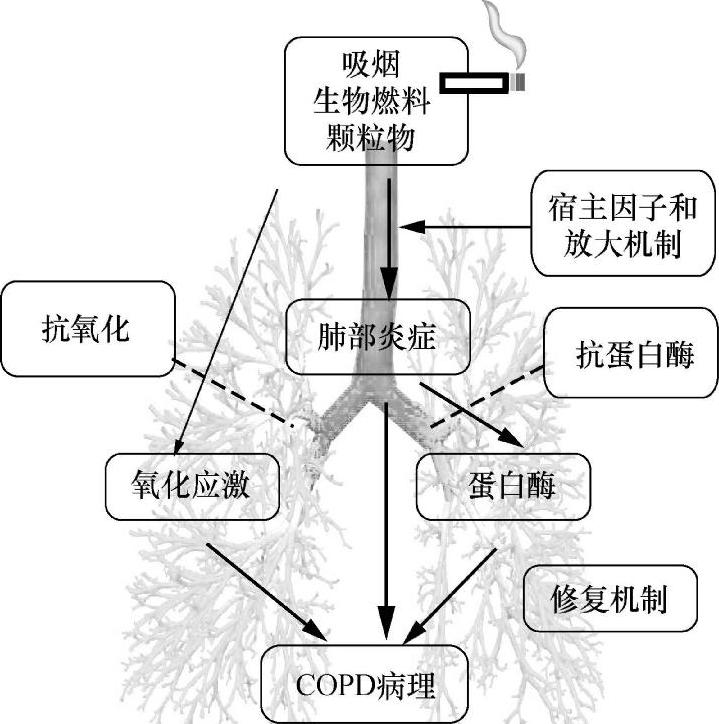
图2 COPD的发病机制
炎症COPD表现为以中性粒细胞、肺巨噬细胞、淋巴细胞为主的炎症反应,这些细胞释放炎症介质,并与气道和肺实质的结构细胞相互作用。
COPD以气道、肺实质和肺血管的慢性炎症为特征,在肺的不同部位有肺泡巨噬细胞、T淋巴细胞(尤其是CD+8)和中性粒细胞增加,部分患者有嗜酸粒细胞增多。激活的炎症细胞释放多种介质,包括白三烯B1(LTB4)、白介素8(IL-8)、肿瘤坏死因子α(TNF-α)和其他介质。这些介质能破坏肺的结构和(或)促进中性粒细胞炎症反应。吸人有害颗粒或气体可导致肺部炎症;吸烟能诱导炎症并直接损害肺;C0PD的各种危险因素都可产生类似的炎症过程,从而导致COPD的发生。表1显示了参与COPD的炎症介质。

表1 参与COPD的炎症介质
氧化应激 氧化应激是加重COPD炎症的重要机制。香烟烟雾和其他吸入颗粒能产生氧化物,由活化的炎症细胞如巨噬细胞和中性粒细胞释放。COPD患者内源性抗氧化物产生下降。氧化应激对肺组织可造成一些不利的影响,包括激活炎症基因、使抗蛋白酶失活、刺激黏液高分泌,并增加血浆渗出。这些有害反应大多数是由过硝酸盐介导,通过超氧阴离子和一氧化氮的相互作用产生。而一氧化氮是由诱导型一氧化氮合酶产生,主要表达在COPD患者的外周气道和肺实质。氧化应激也能引起COPD患者肺组织组蛋白去乙酰酶活性下降,导致炎症基因表达增加,同时糖皮质激素的抗炎活性下降
蛋白酶和抗蛋白酶的失衡COPD患者肺组织中分解结缔组织的蛋白酶和对抗此作用的抗蛋白酶之间存在失衡。COPD患者中炎症细胞和上皮细胞释放的几种蛋白酶表达增加,并存在相互作用。弹性蛋白是肺实质结缔组织的主要成分,蛋白酶引起弹性蛋白破坏,是导致肺气肿的重要原因,而肺气肿是不可逆的。
由于遗传因素或炎症细胞和介质的作用,肺内源性蛋白酶和抗蛋白酶失衡,为肺气肿形成的主要机制。
自主神经系统功能紊乱 胆碱能神经张力增高也在COPD发病中起重要作用。参与的主要因素有:①迷走神经反射增强:由于气道的慢性非特异性炎症,使得分布于气道上皮细胞间及上皮细胞下的刺激性受体的活性阈值降低,对烟雾等化学机械性刺激的敏感性提高,通过迷走神经反射,使乙酰胆碱(Ach)释放增加。②突触前受体的功能异常:在胆碱能神经末梢存在一些对Ach释放起着负反馈抑制作用的受体,如组胺H、受体、肾上腺素能β2受体、α2受体及M2受体,这些突触前受体的功能障碍,均导致Ach释放的增加。③抑制性非肾上腺素能非胆碱能(iNANC)神经功能障碍:iNANC神经释放的血管活性肠肽(VIP)除能拮抗Ach所致的气道平滑肌痉挛外,还能抑制胆碱能神经传递,抑制Ach的释放。VIP分泌减少或功能障碍均可导致Ach释放增加。④基础迷走神经张力作用增强:正常人在安静状态下,迷走神经持续发放一定的冲动,以维持气道一定的张力,给正常人抗胆碱能药物或肺移植时切断迷走神经均能引起支气管舒张,证实了基础迷走神经张力的存在。在COPD患者,由于气道黏膜充血水肿,黏液腺肥大,黏液栓塞,导致管腔狭窄,使迷走神经的基础张力明显增强。⑤副交感神经节后纤维所释放的Ach是通过靶细胞上M受体而发挥作用,COPD患者存在M受体的数量或功能的异常,参与了胆碱能神经张力增高。
病理COPD特征性的病理学改变存在于中央气道、外周气道、肺实质和肺的血管系统。在中央气道(气管、支气管以及内径大于2~4mm的细支气管),表层上皮炎症细胞浸润,黏液分泌腺增大和杯状细胞增多使黏液分泌增加。在外周气道(内径小于2mm的小支气管和细支气管)内,慢性炎症导致气道壁损伤和修复过程反复循环发生。修复过程导致气道壁结构重构,胶原含量增加及瘢痕组织形成,这些病理改变造成气腔狭窄,引起固定性气道阻塞。
COpD患者典型的肺实质破坏表现为小叶中央型肺气肿,涉及呼吸性细支气管的扩张和破坏。病情较轻时,这些破坏常发生于肺的上部区域,但病情发展,可弥漫分布于全肺,并有肺毛细血管床的破坏。
COPD肺血管的改变以血管壁的增厚为特征,这种增厚始于疾病的早期。内膜增厚是最早的结构改变,接着出现平滑肌增加和血管壁炎症细胞浸润。COPD加重时,平滑肌、蛋白多糖和胶原的增多进一步使血管壁增厚。COPD晚期继发肺心病时,部分患者可见多发性肺细小动脉原位血栓形成。
病理生理在COPD肺部病理学改变的基础上出现相应COPD特征性病理生理学改变,包括黏液高分泌、纤毛功能失调、气流受限、肺过度充气、气体交换异常、肺动脉高压和肺心病以及全身的不良效应。黏液高分泌和纤毛功能失调导致慢性咳嗽及多痰。呼气气流受限,是COPD病理生理改变的标志,是疾病诊断的关键。主要由气道固定性阻塞及随之发生的气道阻力增加所致。
小气道炎症程度、纤维化和腔内渗出物与FEV1,FEV1/FVC降低相关,并且可能与COPD的特征性表现FEV1进行性下降相关。外周气道阻塞使得在呼气时气体陷闭,导致过度充气。尽管肺气肿引起气体交换异常比引起FEV1下降更为常见,但在呼气时能促进气体陷闭,尤其是当疾病发展到重度时,肺泡与小气道的支撑结构受到破坏。过度充气使吸气容积下降,导致功能残气量增加,尤其是在运动时,引起呼吸困难和运动能力受限。目前认为,过度充气在疾病早期即可出现,是引起劳力性呼吸困难的主要原因。作用在外周气道的支气管扩张剂能减轻气体陷闭,因此可降低肺容积,改善症状和运动能力。
随着COPD的进展,外周气道阻塞、肺实质破坏及肺血管的异常等减少了肺气体交换能力,产生低氧血症,以后可出现高碳酸血症。长期慢性缺氧可导致肺血管广泛收缩和肺动脉高压,常伴有血管内膜增生,某些血管发生纤维化和闭塞,造成肺循环的结构重塑。COPD晚期出现的肺动脉高压是其重要的心血管并发症,并进而产生慢性肺源性心脏病及右心衰竭,提示预后不良。
COPD的炎症反应不只局限于肺部,也可以导致全身不良效应。全身炎症表现为全身氧化负荷异常增高、循环血液中细胞因子浓度异常增高以及炎症细胞异常活化等。患者骨质疏松、抑郁、慢性贫血及心血管疾病风险增加。COPD的全身不良效应具有重要的临床意义,它可加剧患者的活动能力受限,使生活质量下降,预后变差。
临床表现病史特征
症状
1.慢性咳嗽 通常为首发症状。初起咳嗽呈间歇性,早晨较重,以后早晚或整日均有咳嗽,但夜间咳嗽并不显著。少数病例咳嗽不伴咳痰。也有部分病例虽有明显气流受限但无咳嗽症状。
2.咳痰 咳嗽后通常咳少量黏液性痰,部分患者在清晨较多;合并感染时痰量增多,常有脓性痰。
3.气短或呼吸困难 这是COPD的标志性症状,是使患者焦虑不安的主要原因,早期仅于劳力时出现,后逐渐加重,以致日常活动甚至休息时也感气短。
4.喘息和胸闷 不是COPD的特异性症状。部分患者特别是重度患者有喘息;胸部紧闷感通常于劳力后发生,与呼吸费力、肋间肌等容性收缩有关。
5.全身性症状 在疾病的临床过程中,特别在较重的患者,可能会发生全身性症状,如体重下降、食欲减退、外周肌肉萎缩和功能障碍、精神抑郁和(或)焦虑等。合并感染时可咳血痰或咯血。
体征
实验室检查肺功能检查
胸部X线检查
胸部CT检查
血气检查
其他实验室检查
严重度分级COPD严重度分级是基于气流受限的程度。气流受限是诊断COPD的主要指标,也反映了病理改变的严重度。由于FEV1下降与气流受限有很好的相关性,故FEV1的变化是严重度分级的主要依据。此外,还应考虑临床症状及合并症的情况。临床严重度分为四级(表2)。

表2 COPD临床严重度分级
1.Ⅰ级 轻度COPD:其特征为轻度气流受限,FEV1≥80%预计值,通常可伴有或不伴有咳嗽、咳痰。此时,患者本人可能还认识不到自己的肺功能是异常的。
2.Ⅱ级 中度COPD:其特征为气流受限进一步恶化,50%≤FEV1<80%预计值,症状进展,出现气短,以运动后气短更为明显。此时,由于呼吸困难或疾病的加重,患者常去医院就诊。
3.Ⅲ级 重度COPD:其特征为气流受限进一步恶化(30%≤FEV1<50%预计值),气短加剧,并且反复出现急性加重,影响患者的生活质量。
4.Ⅳ级 极重度COPD:为严重的气流受限(FEV1<30%预计值)或者合并有慢性呼吸衰竭。也可影响心脏,导致肺源性心脏病(右心功能不全)。此时,患者的生活质量明显下降,如果出现急性加重则可能有生命危险。虽然FEV1%预计值可以反映COPD严重程度和健康状况,预测病死率,但FEV1并不能完全反映COPD复杂的严重情况。除FEV1以外,已证明体重指数(BMI)和呼吸困难分级在预测COPD生存率等方面有意义。BMI等于体重(以kg为单位)除以身高的平方(以m2为单位),BMI<21kg/m2的COPD患者死亡率增加。
功能性呼吸困难分级:可用呼吸困难量表来评价:0级:除非剧烈活动,通常无明显呼吸困难;1级:当快走或上缓坡时有气短;2级:由于呼吸困难,比同龄人步行慢,或者以自己的速度在平地上行走时需要停下来呼吸;3级:在平地上步行100米或数分钟后需要停下来呼吸;4级:明显的呼吸困难而不能离开房屋或者当穿脱衣服时气短。
如果将BMI作为反映营养状况的指标,FEV1可作为反映气流阻塞(ObstructioN)的指标,呼吸困难(dyspnea)分级作为症状的指标,再加上6分钟步行距离作为运动耐力(exercise)的指标,将这四方面综合起来建立一个多因素分级系统(BODE),被认为可比FEV1更好地反映COPD的预后。
生活质量评估:广泛应用于评价COPD患者的病情严重程度、药物治疗的疗效、非药物治疗的疗效(如肺康复治疗、手术)和急性发作的影响等。生活质量评估还可用于预测死亡风险,而与年龄、FEV1及体重指数无关。常用的生活质量评估方法有圣乔治呼吸问卷(SGRQ)和治疗结果研究(SF-36)等。
此外,COPD急性加重次数也可作为COPD严重程度的一项监测指标。
COPD病程可分为急性加重期与稳定期。COPD急性加重期是指患者出现超越日常状况的持续恶化,并需改变基础COPD的常规用药者,通常在疾病过程中,患者短期内咳嗽、咳痰、气短和喘息加重,痰量增多,呈脓性或黏脓性,可伴发热等炎症明显加重的表现。稳定期则指患者咳嗽、咳痰、气短等症状稳定或症状轻微。
诊断CoPD的诊断应根据临床表现、危险因素接触史、体征及实验室检查等资料,进行综合分析确定。
病史既往史和系统回顾:童年时期有无哮喘、变态反应性疾病、感染及其他呼吸道疾病史如结核病史;COPD和呼吸系统疾病家族史;吸烟史(以包年计算)及职业、环境有害物质接触史等。
症状主要为慢性咳嗽,咳痰和/或呼吸困难,多于冬季发作或加重。
鉴别诊断一些已知病因或具有特征病理表现的气流受限疾病,如支气管扩张症、肺结核纤维化病变、肺囊性纤维化、弥漫性泛细支气管炎以及闭塞性细支气管炎等,均不属于COPD。COPD应与支气管哮喘、支气管扩张症、充血性心力衰竭、肺结核等鉴别(表3、表4)。

表3 COPD与哮喘的鉴别
与支气管哮喘的鉴别有时存在一定困难。COPD多于中年后起病,哮喘则多在儿童或青少年期起病;COPD症状缓慢进展,逐渐加重,哮喘则症状起伏大;COPD多有长期吸烟史和(或)有害气体、颗粒接触史,哮喘则常伴过敏体质、过敏性鼻炎和/或湿疹等,部分患者有哮喘家族史;COPD的气流受限基本为不可逆性,哮喘则多为可逆性。然而,部分病程长的哮喘患者已发生气道重塑,气流受限不能完全逆转;而少数COPD患者伴有气道高反应性,气流受限部分可逆。此时应根据临床及实验室所见全面分析,必要时作支气管舒张试验和/或最大呼气流量(PEF)昼夜变异率来进行鉴别。在一部分患者中,这两种疾病可重叠存在。

表4 COPD的鉴别诊断
支气管哮喘主要症状为喘息、两肺广泛呼气相哮鸣音,多与接触变应原有关,对糖皮质激素治疗反应良好。虽然哮喘与COPD都是慢性气道炎症性疾病,但二者的发病机制不同。大多数哮喘患者的气流受限具有显著的可逆性,是其不同于COPD的一个关键特征;但是,部分哮喘患者随着病程延长,可出现较明显的气道重塑,导致气流受限的可逆性明显减小,临床很难与COPD相鉴别。COPD和哮喘可以发生于同一位患者,由于二者都是呼吸系统最常见的疾病,因此这种概率并不低。
治疗稳定期治疗
1.教育与管理 通过教育与管理可以提高患者及有关人员对COPD的认识和自身处理疾病的能力,更好地配合治疗和加强预防措施,减少反复加重,维持病情稳定,提高生活质量。主要内容包括:①教育与督促患者戒烟;②使患者了解COPD的病理生理与临床基础知识;③掌握一般和某些特殊的治疗方法;④学会自我控制病情的技巧,如腹式呼吸及缩唇呼吸锻炼等;⑤了解赴医院就诊的时机;⑥社区医生定期随访管理。
2.控制职业性或环境污染 避免或防止粉尘、烟雾及有害气体吸入。
3.药物治疗 药物治疗用于预防和控制症状,减少急性加重的频率和严重程度,提高运动耐力和生活质量。根据疾病的严重程度,逐步增加治疗,如果没有出现明显的药物副作用或病情的恶化,应在同一水平维持长期的规律治疗。根据患者对治疗的反应及时调整治疗方案。(1)支气管舒张剂:支气管舒张剂可松弛支气管平滑肌、扩张支气管、缓解气流受限,是控制COPD症状的主要治疗措施。短期按需应用可缓解症状,长期规则应用可预防和减轻症状,增加运动耐力,但不能使所有患者的FEV1得到改善。与口服药物相比,吸入剂副作用小,因此多首选吸入治疗。
主要的支气管舒张剂有β2激动剂、抗胆碱药及甲基黄嘌呤类,根据药物的作用及患者的治疗反应选用。定期用短效支气管舒张剂较为便宜,但不如长效制剂方便。不同作用机制与作用时间的药物联合可增强支气管舒张作用、减少副作用。β2受体激动剂、抗胆碱药物和(或)茶碱联合应用,肺功能与健康状况可获进一步改善。
1)β2受体激动剂:主要有沙丁胺醇、特布他林等,为短效定量雾化吸入剂,数分钟内开始起效,15~30min达到峰值,持续疗效4~5h,每次剂量100~200μg(每喷100μg),24h不超过8~12喷。主要用于缓解症状,按需使用。福莫特罗(formoterol)为长效定量吸入剂,作用持续1 2h以上,与短效β2激动剂相比,更有效方便。福莫特罗吸入后1~3min起效,常用剂量为4.5~9μg,每日2次。
2)抗胆碱药:主要品种有异丙托溴铵(ipratropium)气雾剂,可阻断M胆碱受体。定量吸入时,开始作用时间比沙丁胺醇等短效β2受体激动剂慢,但持续时间长,30~90min达最大效果。维持6~8h,剂量为40~80μg(每喷20μg),每天3~4次。该药副作用小,长期吸入可改善COPD患者健康状况。噻托溴铵(tiotropium bromide)选择性作用于M3和M1受体,为长效抗胆碱药,作用长达24h以上,吸入剂量为18μg,每天1次。长期吸入可增加深吸气量(IC),减低呼气末肺容积(EELV),进而改善呼吸困难,提高运动耐力和生活质量,也可减少急性加重频率。
3)茶碱类药物:可解除气道平滑肌痉挛,在COPD应用广泛。另外,还有改善心搏血量、舒张全身和肺血管,增加水盐排出,兴奋中枢神经系统,改善呼吸肌功能以及某些抗炎作用等。但总的来看,在一般治疗量的血药浓度下,茶碱的其他多方面作用不很突出。缓释型或控释型茶碱每天1次或2次口服可达稳定的血浆浓度,对COPD有一定效果。茶碱血浓度监测对估计疗效和副作用有一定意义。血茶碱浓度﹥5mg/L即有治疗作用;﹥15mg/L时副作用明显增加。吸烟、饮酒、服用抗惊厥药、利福平等可引起肝酶受损并可缩短茶碱半衰期;老人、持续发热、心力衰竭和肝功能明显障碍者,及同时应用西咪替丁、大环内酯类药物(红霉素等)、氟喹诺酮类药物(环丙沙星等)和口服避孕药等都可能使茶碱血浓度增加。
(2)糖皮质激素:COPD稳定期长期应用糖皮质激素吸入治疗并不能阻止其FEV1的降低趋势。长期规律地吸入糖皮质激素较适用于FEV1<50%预计值(Ⅲ级和Ⅳ级)并且有临床症状以及反复加重的COPD患者。这一治疗可减少急性加重频率,改善生活质量。联合吸入激素和β2激动剂,比各自单用效果好,目前已有布地奈德/福莫特罗、氟地卡松/沙美特罗两种联合制剂。对COPD患者,不推荐长期口服糖皮质激素治疗。
(3)其他药物
1)祛痰药(黏液溶解剂):COPD气道内可产生大量黏液分泌物,可促使继发感染,并影响气道通畅,应用祛痰药似乎有利于气道引流通畅,改善通气,但除少数有黏痰患者获效外,总体来说效果并不十分确切。常用药物有盐酸氨溴索(Ambroxol)、乙酰半胱氨酸等。
2)抗氧化剂:COPD气道炎症使氧化负荷加重,应用抗氧化剂如N-乙酰半胱氨酸可降低疾病反复加重的频率。
3)免疫调节剂:对降低COPD急性加重的严重程度可能具有一定的作用。但尚未得到确证,不推荐作常规使用。
4)疫苗:流感疫苗可减少COPD患者的病情严重程度和死亡率,建议每年给予1次(秋季)或2次(秋、冬)。它含有死的或活的、无活性病毒,应每年根据预测的病毒种类制备。肺炎球菌疫苗含有23种肺炎球菌荚膜多糖,已在COPD患者中应用,但疗效尚缺乏有说服力的研究证实。
5)中医治疗:辨证施治是中医治疗的原则,对COPD的治疗亦应据此原则进行。实践中体验到某些中药具有祛痰、支气管舒张、免疫调节等作用,值得深入研究。
4.氧疗 COPD稳定期进行长期家庭氧疗(LTOT)对具有慢性呼吸衰竭的患者可提高生存率。对血流动力学、血液学特征、运动能力、肺生理和精神状态都会产生有益的影响。LTOT应在Ⅳ级极重度的CopD患者中应用,具体指征是:①PaO2≤7.3kPA(55mmHg)或动脉血氧饱和度(SaO2)≤88%,有或没有高碳酸血症。②PaO27.3~8.0kPa(55~60mmHg),或SAaO2<89%,并有肺动脉高压、心脏衰竭所致水肿或红细胞增多症(红细胞比积>55%)。LTOT一般是经鼻导管吸入氧气,流量1.0~2.0L/min,吸氧持续时间>15h/d。长期氧疗的目的是使患者在海平面水平、静息状态下,达到PaO2≥60mmHg和(或)使SaO2升至90%,这样才可维持重要器官的功能,保证周围组织的氧供。
5.康复治疗 康复治疗可以使进行性气流受限、严重呼吸困难而很少活动的患者改善活动能力、提高生活质量,是COPD患者一项重要的治疗措施。它包括呼吸生理治疗、肌肉训练、营养支持、精神治疗与教育等多方面措施。在呼吸生理治疗方面包括帮助患者咳嗽,用力呼气以促进分泌物清除;使患者放松,进行缩唇呼吸以及避免快速浅表的呼吸以帮助克服急性呼吸困难等措施。在肌肉训练方面有全身性运动与呼吸肌锻炼,前者包括步行、登楼梯、踏车等,后者有腹式呼吸锻炼等。在营养支持方面,应要求达到理想的体重;同时避免过高碳水化合物饮食和过高热卡摄入,以免产生过多二氧化碳。
6.外科治疗
(1)肺大疱切除术:在有指征的患者,术后可减轻患者呼吸困难的程度并使肺功能得到改善。术前胸部CT检查、动脉血气分析及全面评价呼吸功能对于决定是否手术是非常重要的。
(2)肺减容术:是通过切除部分肺组织,减少肺过度充气,改善呼吸肌做功,提高运动能力和健康状况,但不能延长患者的寿命。主要适用于上叶明显非均质肺气肿,康复训练后运动能力仍低的一部分病人,但其费用高,属于实验性姑息性外科的一种手术。不建议广泛应用。
(3)肺移植术:对于选择合适的COPD晚期患者,肺移植术可改善生活质量,改善肺功能,但技术要求高,花费大,很难推广应用。总之,稳定期COPD的处理原则应根据病情的严重程度不同,选择的治疗方法也有所不同,关于COPD分级治疗问题,表5可供参考。
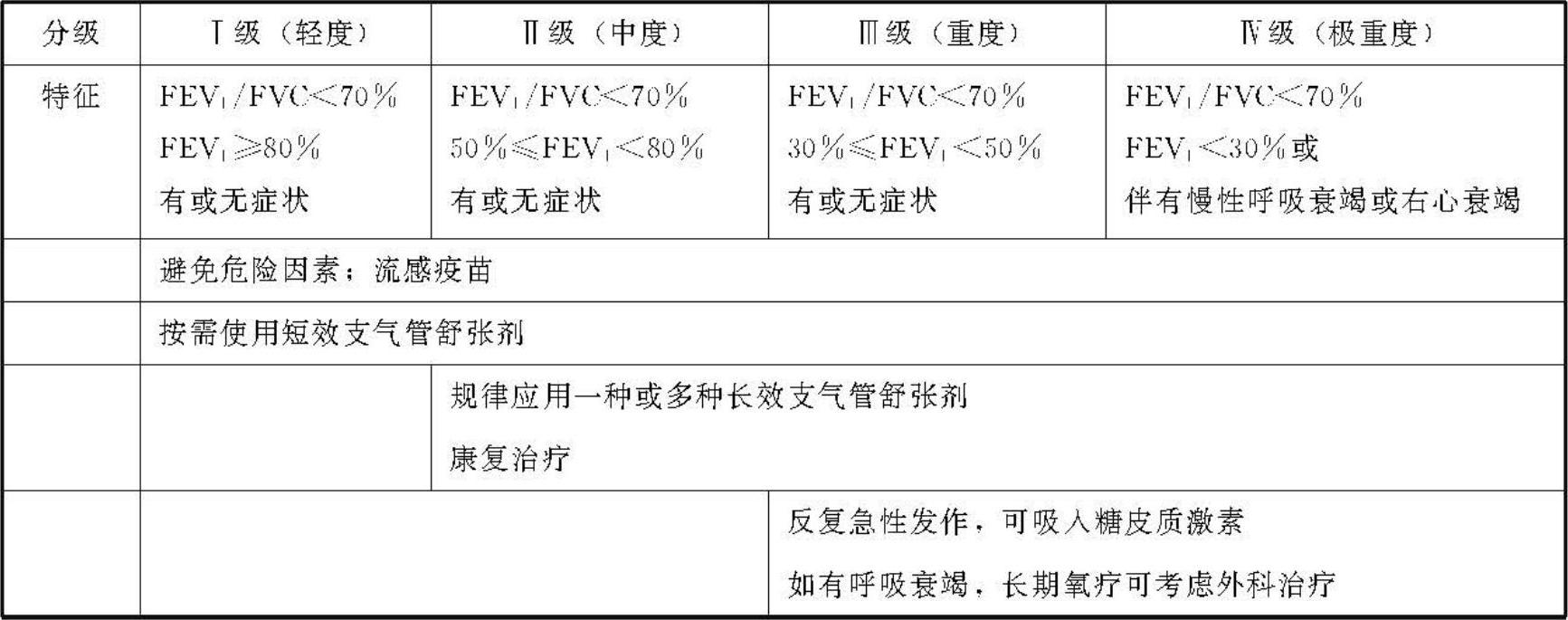
表5 稳定期COPD的推荐治疗方案
 急性加重期的治疗
急性加重期的治疗
1.确定COPD急性加重的原因 引起COPD加重的最常见原因是气管-支气管感染,主要是病毒、细菌的感染。部分病例加重的原因难以确定,环境理化因素改变可能有作用。肺炎、充血性心力衰竭、心律失常、气胸、胸腔积液、肺血栓栓塞症等可引起酷似COPD急性发作的症状,需要仔细加以鉴别。
2.COPD急性加重的诊断和严重性评价 COPD加重的主要症状是气促加重,常伴有喘息、胸闷、咳嗽加剧、痰量增加、痰液颜色和(或)黏度改变以及发热等,此外亦可出现全身不适、失眠、嗜睡、疲乏抑郁和精神紊乱等症状。当患者出现运动耐力下降、发热和(或)胸部影像异常时可能为COPD加重的征兆。气促加重,咳嗽痰量增多及出现脓性痰常提示细菌感染。
与加重前的病史、症状、体征、肺功能测定、动脉血气检测和其他实验室检查指标进行比较,对判断COPD加重的严重度甚为重要。应特别注意了解本次病情加重或新症状出现的时间,气促、咳嗽的严重度和频度,痰量和痰液颜色,日常活动的受限程度,是否曾出现过水肿及其持续时间,既往加重时的情况和有无住院治疗,以及目前的治疗方案等。本次加重期肺功能和动脉血气结果与既往对比可提供极为重要的信息,这些指标的急性改变较其绝对值更为重要。对于严重的COPD患者,神志变化是病情恶化和危重的指标,一旦出现需及时送医院救治。是否出现辅助呼吸肌参与呼吸运动,胸腹矛盾呼吸、发绀、外周水肿、右心衰竭,血流动力学不稳定等征象亦有助于判定COPD加重的严重程度。
(1)肺功能测定:加重期患者,常难以满意地完成肺功能检查。FEV1<1L可提示严重发作。
(2)动脉血气分析:在海平面呼吸空气条件下,PAO2<60mmHg和(或)SaO2<90%,提示呼吸衰竭。如pAO2<50mmHg,PaCO2﹥70mmHg,pH<7.30提示病情危重,需进行严密监护或入住ICU行无创或有创机械通气治疗。
(3)胸部X线影像、心电图(ECG)检查:胸部X线影像有助于COPD加重与其他具有类似症状的疾病相鉴别。ECG对心律失常、心肌缺血及右心室肥厚的诊断有帮助。螺旋CT、血管造影和血浆D-二聚体检测对诊断COPD加重患者发生肺栓塞有重要作用,但核素通气灌注扫描对此诊断价值不大。低血压或高流量吸氧后PaO2不能升至60mmHg以上可能提示肺栓塞的存在,如果临床上高度怀疑合并肺栓塞,则应同时处理COPD和肺栓塞。
(4)其他实验室检查:血红细胞计数及红细胞压积有助于了解有无红细胞增多症或出血。部分患者血白细胞计数增高及中性粒细胞核左移可为气道感染提供佐证,但通常白细胞计数并无明显改变。
当COPD症状加重且有脓性痰者,应给予抗生素治疗。肺炎链球菌、流感嗜血杆菌及卡他莫拉菌是导致COPD加重最常见的病原菌。若患者对初始抗生素治疗反应不佳时,应进行痰培养及细菌药物敏感试验。此外,血液生化检查有助于确定引起COPD加重的其他因素,如电解质紊乱(低钠、低钾和低氯血症等),糖尿病危象或营养不良等,也可发现合并存在的代谢性酸碱失衡。
3.院外治疗 对于COPD加重早期,病情较轻的患者可以在院外治疗,但需注意病情变化,及时决定送至医院治疗的时机。
COPD加重期的院外治疗包括适当增加以往所用支气管舒张剂的量及频度。若未曾使用抗胆碱药物,可以用异丙托溴胺或噻托溴胺吸入治疗,直至病情缓解。对更严重的病例,可给予数天较大剂量的雾化治疗,如沙丁胺醇2500μg,异丙托溴铵500μg,或沙丁胺醇1 000μg加异丙托溴铵250~500μg雾化吸入,每日2~4次。
全身使用糖皮质激素对加重期治疗有益,可促进病情缓解和肺功能恢复。如患者的基础FEV1<50%预计值,除支气管舒张剂外可考虑口服糖皮质激素,泼尼松龙,每日30~40mg,连用7~10天。也可糖皮质激素联合长效β2受体激动剂雾化吸入治疗。
COPD症状加重,特别是咳嗽痰量增多并呈脓性时应积极给予抗生素治疗。抗生素选择应依据患者肺功能及常见的致病菌结合患者所在地区致病菌及耐药流行情况,选择敏感抗生素。在院外治疗的COPD急性加重患者,通常病情都不很重。主要病原体多为流感嗜血杆菌、肺炎链球菌、卡他莫拉菌、病毒等。因此,除确诊为单纯病毒感染可不应用抗菌药物外,都应给予适当的抗菌药物。可选择以下药物:青霉素、β内酰胺类/酶抑制剂(阿莫西林/克拉维酸)、大环内酯类(阿奇霉素、克拉霉素、罗红霉素等),第一代或二代头孢菌素(头孢呋辛、头孢克洛)、多西环素、左氧氟沙星等,这些药物除青霉素外,可使用口服制剂,较重者注射给药。
4.住院治疗 COPD急性加重病情严重者需住院治疗。COPD急性加重到医院就诊或住院治疗的指标为:①症状显著加剧,如突然出现的静息状况下呼吸困难;②出现新的体征或原有体征加重(如发绀、外周水肿);③新近发生的心律失常;④有严重的伴随疾病;⑤初始治疗方案失败;⑥高龄COPD患者的急性加重;⑦诊断不明确;⑧院外治疗条件欠佳或治疗不力。
COPD急性加重收入重症监护治疗病房(ICU)的指征为:①严重呼吸困难且对初始治疗反应不佳;②精神障碍、嗜睡、昏迷;③经氧疗和无创正压通气(NIPPV)后,低氧血症(PAO2< 50mmHg)仍持续或呈进行性恶化,和(或)高碳酸血症(PaCO2﹥70mmHg)无缓解甚至恶化,和(或)严重呼吸性酸中毒(pH<7.30)无缓解,甚至恶化。
5.COPD加重期的主要治疗方案
1)根据症状、血气分析结果、X线胸片等评估病情的严重程度。
2)控制性氧疗:氧疗是COPD加重期住院患者的基础治疗。无严重合并症的COPD加重期患者氧疗后易达到满意的氧合水平(PaO2﹥60mmg或SaO2﹥90%)。但吸入氧浓度不宜过高,需注意可能发生潜在的CO2潴留及呼吸性酸中毒,给氧途径包括鼻导管或Venturi面罩,其中Venturi面罩更能精确地调节吸入氧浓度。氧疗30min后应复查动脉血气,以确认氧合满意,且未引起CO2潴留及(或)呼吸性酸中毒。
3)抗生素治疗:COPD急性加重多由细菌感染诱发,故抗生素治疗在COPD加重期治疗中具有重要地位。当患者呼吸困难加重,咳嗽伴有痰量增多及脓性痰时,应根据COPD严重程度及相应的细菌分层情况,结合当地常见的致病菌类型及耐药流行趋势和药敏情况尽早选择敏感抗生素。如对初始治疗方案反应欠佳,应及时根据细菌培养及药敏试验结果调整抗生素。通常COPDⅠ级(轻度)或Ⅱ级(中度)患者病情加重时,主要致病菌多为肺炎链球菌、流感嗜血杆菌及卡他莫拉菌。属于CopDⅢ级(重度)及Ⅳ级(极重度)患者病情急性加重,除以上常见细菌外,尚可有肠杆菌科细菌、铜绿假单胞菌及耐甲氧西林金黄色葡萄球菌等。发生铜绿假单胞菌的危险因素有:近期住院、频繁应用抗菌药物、以往有铜绿假单胞菌分离或寄植的历史等。需要根据细菌可能的分布采用适当的抗菌药物治疗(具体用药见表6)。抗菌治疗应尽可能将细菌负荷降低到最低水平,以延长COPD急性加重的间隔时间。长期应用广谱抗生素和糖皮质激素易继发深部真菌感染,应密切观察真菌感染的临床征象并采用防治真菌感染措施。抗生素使用疗程一般情况下为3~7天,根据病情需要可适当延长。在我国,目前疗程往往偏长。

表6 住院患者抗生素应用参考表
4)支气管舒张剂:短效β2受体激动剂较适用于COPD急性加重期的治疗。若效果不显著,建议加用抗胆碱能药物(为异丙托溴铵、噻托溴铵等)。对于COPD急性加重者,可考虑静脉滴注茶碱类药物。由于茶碱类药物血清浓度个体差异较大,治疗窗较窄,监测血清茶碱浓度对于评估疗效和避免副作用的发生都有一定意义。β2受体激动剂、抗胆碱能药物及茶碱类药物由于作用机制不同,药代及药动学特点不同且分别作用于不同大小的气道,所以应联合应用,可获得更大的支气管舒张作用。不良反应的报道亦不多。
5)糖皮质激素:COPD急性加重期住院患者宜在应用支气管舒张剂基础上,口服或静脉滴注糖皮质激素,激素的剂量要权衡疗效及安全性,建议口服泼尼松30~40mg/d,连续7~10天后逐渐减量停药。也可以静脉给予甲泼尼龙,40mg每天一次,3~5天后改为口服。延长给药时间不能增加疗效,相反会使副作用增加。
6)机械通气:可通过无创或有创方式给予机械通气,根据病情需要,可首选无创性机械通气。机械通气无论是无创或有创方式都只是生命支持的一种方式。在此基础下,通过有效药物治疗消除COPD急性加重的原因使急性呼吸衰竭得到逆转。进行机械通气病人应监测动脉血气。
①无创机械通气:COPD急性加重期患者应用无创正压通气(NIPPV)可降低PaCO2,减轻呼吸困难,从而降低气管插管和有创呼吸机的使用率,缩短住院天数,降低患者死亡率。使用NIPPV要注意掌握合理的操作方法,提高患者依从性,避免漏气,从低压力开始逐渐增加辅助吸气压和采用有利于降低PaCO2的方法,从而提高NIPPV的效果。其应用指征见表7.

表7 NIPPV在COPD急性加重期应用的适应证和禁忌证
②有创机械通气:在积极药物和NIPPV治疗下,患者呼吸衰竭仍进行性恶化,出现危及生命的酸碱异常和/或神志改变时宜用有创机械通气治疗。
有创机械通气在COPD急性加重期的具体应用指征见表8。

表8 有创机械通气在COPD急性加重期的应用指征
在决定终末期COPD患者是否使用机械通气时,还需充分考虑到病情好转的可能性,患者自身及家属的意愿以及强化治疗的条件是否允许。
使用最广泛的三种通气模式包括辅助控制通气(A-CMV),压力支持通气(PSV)或同步间歇强制通气(SIMV)与PSV联合模式(SIMV+PSV)。因COPD患者广泛存在内源性呼气末正压(PEEPi),为减少因PEEPi所致吸气功耗增加和人机不协调,可常规加用一适度水平(约为PEEPi的70%~80%)的外源性呼气末正压(PEEP)。COPD的撤机可能会遇到困难,需设计和实施周密方案。使用感染控制窗为切换点的有创-无创序贯通气已被证实为临床实用而有效的方法,常用来帮助COPD急性加重期患者早期撤离有创呼吸机治疗。
7)其他:在出入量和血电解质监测下适当补充液体和电解质;注意维持液体和电解质平衡;注意补充营养,对不能进食者需经胃肠补充要素饮食或予静脉高营养;对卧床、红细胞增多症或脱水的患者,无论是否有血栓栓塞性疾病史均需考虑使用肝素或低分子肝素;注意痰液引流,积极排痰治疗(如刺激咳嗽,叩击胸部,体位引流等方法);识别并治疗伴随疾病(冠心病、糖尿病、高血压等)及合并症(休克、弥散性血管内凝血、上消化道出血、心功能不全等)。
处置建议
非药物治疗极重度COPD稳定期、合并阻塞性睡眠呼吸暂停综合征推荐使用无创通气
手术治疗肺大疱切除术、肺减容术、支气管镜下肺减容术、肺移植术对于部分患者可改善症状
用药建议
支气管扩张剂主要治疗,多为吸入药物
抗胆碱能药、长效β2-受体激动剂、茶碱
糖皮质激素不推荐单独吸入激素治疗。严重气道阻塞者(FEV1≤50%预计值且有症状,及反复加重者)需吸入糖皮质激素治疗,可联合支气管扩张剂治疗
吸入性糖皮质激素、吸入糖皮质激素/β2受体激动剂
磷酸二酯酶-4抑制剂抑制细胞内环腺苷酸降解减轻炎症
罗氟司特
对症治疗祛痰药、抗氧化剂、中成药等
检查建议
确诊检查肺功能检查为诊断金标准,且用于评估病情。需行肺通气功能和舒张试验
鉴别诊断胸部X线和胸部CT
并发症检查FEV1<40%预计值时需检测SpO2。SpO2<92%,行血气分析
PaO2<55mmHg,行血常规了解Hb
患者指导
危险因素控制戒烟、控制职业性或环境污染
营养达到理想体重,避免摄入高碳水化合物和高热量饮食
运动肌肉训练,包括全身运动(步行、登楼梯和踏车)和呼吸肌锻炼(腹式呼吸训练)
康复呼吸生理治疗,适应症:进行性气流受限、严重呼吸困难,且很少活动者
帮助咳嗽,促进排痰,使病人放松,缩唇呼吸及避免快速浅表呼吸
预防每年秋季1次或秋冬2次接种流感疫苗,接种肺炎球菌疫苗















