疾病详情
定义系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种病因未明的、自身免疫介导的、以免疫性炎症为突出表现的弥漫性结缔组织病。主要临床特征为血清中出现以ANA为代表的多种自身抗体和多器官受累。SLE患者病情轻重及病程长短具有异质性,自然病程有的表现为临床症状迁延多年,有的则表现为急性危及生命的严重病变。好发于育龄期女性,多见于15~45岁,女∶男为(7~9)∶1,我国SLE的患病率为70/10万人,妇女中则高达113/10万人。
病因和发病机制SLE的病因和发病机制至今尚不完全清楚。目前认为,SLE的发病与遗传、性激素、环境因素、药物等有关。
1.遗传因素 SLE同卵双胎共患率为25%~70%,在一、二级亲属中SLE患病率则为5%~13%;SLE患者的子女中,SLE的发病率约5%;SLE患者家属中常发现有ANA阳性、高γ球蛋白血症、SLE或其他自身免疫疾病,这些均提示了SLE与遗传的关联。近年大量研究表明SLE的发病是多基因相互作用的结果。
2.性激素 育龄期女性的SLE发病率明显高于同年龄段的男性,也高于青春期以前的儿童和老年女性。SLE患者体内雌性激素水平增高,雄性激素降低及催乳素水平增高可能与SLE的病情活动有关,妊娠后期和产后哺乳期常出现病情加重亦可能与体内的雌激素和催乳素水平有关。
3.紫外线 日光照射可以使SLE皮疹加重、引起疾病活动,被称为光敏感现象。紫外线可以使上皮细胞核的DNA解聚为胸腺嘧啶二聚体,后者具有很强的抗原性,可刺激机体的免疫系统产生大量自身抗体。使SLE患者出现光敏感主要是波长为290~320nm的紫外线B,这种紫外线可以透过云雾层和玻璃,因此即使夏季的阴天,SLE患者户外活动也需注意对紫外线的防护。
4.药物性狼疮 含有芳香族胺基团或联胺基团的药物(如肼苯达嗪、普鲁卡因酰胺、磺胺类药物等)可以诱发药物性狼疮。在许多药物诱导性狼疮患者中可检测到抗组蛋白抗体,可能的原因为这些药物具有与组蛋白类似的结构。药物性狼疮的临床表现和部分血清学特征类似SLE,但内脏很少受累。
5.其他 临床上SLE患者常常因为感染,特别是上呼吸道感染而诱发SLE疾病活动。许多间接的证据提示SLE可能与某些感染因素有关,尤其是病毒感染,并可能通过分子模拟或超抗原作用,破坏自身免疫耐受。
在SLE 受累器官的血管壁的纤维蛋白样沉积物中含有可以产生针对许多自身抗原的自身抗体。自身抗体增高的一个原因可能与B淋巴细胞多克隆活化可致免疫球蛋白水平升高有关。自身抗体水平增高,尤其是抗dsDNA抗体,可形成循环和组织结合型免疫复合物,引起补体固定、炎性细胞募集,从而导致组织损伤。另外,由一些蛋白质进行调节,包括faS和bc1-2等引起的SLE凋亡失调控可致正常情况下本应在形成前即凋亡的自身反应性淋巴细胞存活。巨噬细胞吞噬和处理免疫复合物功能的障碍也有报道。暴露于日光紫外线可使SLE症状恶化,可能是通过核物质损害引起DNA释放并与循环抗dsDNA抗体形成复合物。
病理SⅠLE的受损组织光镜下病理可见:①结缔组织的纤维蛋白样变性:是由免疫复合物和纤维蛋白构成的嗜酸性物质沉积于结缔组织所致;②结缔组织的基质发生黏液性水肿;③坏死性血管炎。
SLE特征性的病理改变为:①苏木紫小体:由ANA与细胞核结合,使之变性形成嗜酸性团块;②“洋葱皮样”病变:小动脉周围有显著向心性纤维增生,明显表现于脾中央动脉以及心瓣膜的结缔组织,反复发生纤维蛋白样变性,形成赘生物。③疣状心内膜炎:疣状心内膜炎是心瓣膜的结缔组织反复发生纤维蛋白样变性,而形成的疣状赘生物,但目前临床已经相当少见。SLE免疫病理包括皮肤狼疮带试验,表现为非阳光暴露部位皮肤的表皮与真皮交界处有免疫球蛋白(IgG、IgM、IgA等)和补体(C3c、C1q等)沉积。狼疮性肾炎的肾免疫荧光表现为“满堂亮”,即可以在免疫荧光显微镜下看到多种免疫球蛋白和补体成分沉积。另外,肾间质、沿肾小管基底膜及肾小管上皮细胞核有时也可以见到免疫荧光阳性。肾病理如肾小球细胞增殖性改变、纤维素样坏死、核碎裂、细胞性新月体、透明栓子、金属环、炎细胞浸润,肾小管间质的炎症等均提示狼疮肾炎活动;而肾小球硬化、纤维性新月体,肾小管萎缩和间质纤维化则是狼疮肾炎慢性指标。国际肾脏病学会/肾脏病理学会(ISN/ RPS)狼疮性肾炎分型(2003年)病理分型见表1。

表1 国际肾病学会/肾病理学会(ISN/RPS)狼疮性肾炎分型(2003年)
临床表现SLE临床表现复杂多样。多数呈隐匿起病,开始仅累及1~2个系统,表现为发热、关节炎、皮疹、隐匿性肾炎、血小板减少性紫癜等,部分患者长期稳定在亚临床状态或轻型狼疮,另有部分患者可由轻型突然转变为重症狼疮,大多数患者则由轻型逐渐出现多系统损害;也有部分患者发病时就累及多个系统,甚至表现为狼疮危象。多数SLE患者的自然病程表现为病情的加重与缓解交替。
1.全身表现SLE患者常常出现发热,多为低至中度发热,可能是SLE活动的表现,但应除外感染因素,尤其是在免疫抑制治疗中出现的发热,更需警惕结核、真菌等感染的可能。乏力是SLE常见的症状,常是狼疮活动的先兆。
2.皮肤与黏膜SLE的皮肤损害包括光敏感、脱发、手足掌面和甲周红斑、盘状红斑、结节性红斑、脂膜炎、网状青斑和雷诺现象等。在鼻梁和双颧颊部呈蝶形分布的红斑是SLE特征性的改变,通常这种红斑不累及鼻唇沟。SLE皮疹无明显瘙痒,接受激素和免疫抑制剂治疗的SLE患者,若出现不明原因局部皮肤灼痛,有可能是带状疱疹的前兆。SLE口腔溃疡或黏膜糜烂亦很常见,在免疫抑制和/或抗生素治疗后的口腔糜烂,应注意口腔真菌感染。
3.关节和肌肉SLE中关节炎和关节痛可达95%以上,可先于其他系统损害几个月至几年出现,常出现对称性多关节疼痛、肿胀,通常不引起骨质破坏,但是少数患者可以出现关节畸形。激素治疗中的SLE患者出现髋关节区域隐痛不适,需注意无菌性股骨头坏死的可能。SLE可出现肌痛和肌无力,少数可有肌酶谱的增高。对于长期服用激素的患者,要除外激素性肌病的可能。
4.肾狼疮性肾炎(lupus nephritis,LN)是SLE最常见和严重的临床表现,肾小球、肾小管及肾血管均可受累,表现为蛋白尿、血尿、管型尿,乃至肾衰竭。50%~70%的SLE病程中会出现临床肾受累,肾活检显示几乎所有SLE均有病理学改变。LN对SLE预后影响甚大,肾衰竭是SLE的主要死亡原因之一。活动性指标高者,肾损害进展较快,但积极治疗可以逆转;慢性指标提示肾不可逆的损害程度,药物治疗只能减缓而不能逆转慢性指数的继续升高。
5.神经系统又称神经精神狼疮。中枢神经系统表现包括无菌性脑膜炎、脑血管病、脱髓鞘综合征、头痛、运动障碍、脊髓病、癫痫发作、急性精神错乱、焦虑、认知障碍、情绪失调、精神障碍等;周围神经系统表现包括吉兰-巴雷综合征、自主神经系统功能紊乱、单神经病变、重症肌无力、脑神经病变、神经丛病变、多发性神经病变等。存在一种或一种以上上述表现,并除外感染、药物等继发因素的情况,结合影像学、脑脊液、脑电图等检查可诊断神经精神狼疮。以弥漫性的高级皮层功能障碍为表现的神经精神狼疮,多与抗神经元抗体、抗核糖体P蛋白抗体相关;有局灶性神经定位体征的神经精神狼疮,又可进一步分为两种情况,一种伴有抗磷脂抗体阳性,另一种常有全身血管炎表现和明显病情活动。横贯性脊髓炎可出现感觉平面障碍、截瘫、括约肌功能障碍、病理征阳性等,脊髓的磁共振检查可明确诊断。虽然横贯性脊髓炎在SLE不多见,但是一旦发生,应尽早积极治疗,否则可以造成不可逆的损伤。
6.血液系统SLE常出现贫血和/或白细胞减少和/或血小板减少。白细胞减少常为淋巴细胞减少,贫血可能为慢性缺铁性贫血或肾性贫血。短期内出现重度贫血常是自身免疫性溶血所致,多有网织红细胞升高,Coomb's试验阳性。SLE的白细胞减少,一般发生在治疗前或疾病复发时,多数对激素治疗敏感;细胞毒药物所致的白细胞减少,其发生与用药相关,停药后可逐渐恢复。血小板减少与血小板抗体、抗磷脂抗体以及骨髓巨核细胞成熟障碍有关。部分患者可出现淋巴结肿大和/或脾大。
7.肺SLE常出现胸膜炎或肺实质病变。如合并胸腔积液,其性质多为渗出液。年轻患者的渗出性浆膜腔积液,除外结核后应注意SLE的可能性。SLE肺实质浸润的放射学特征是阴影分布较广、易变,而咳嗽症状相对较轻,痰量较少,一般不咳黄色黏稠痰,如果SLE患者出现明显的咳嗽、黏稠痰或黄痰,则提示呼吸道感染。结核感染在SLE表现常呈不典型性。持续性发热的患者,应警惕血行播散性肺结核的可能,因此,应每周拍摄胸部X线片,必要时应行肺高分辨率CT(HRCT)检查,并给予痰及支气管-肺泡灌洗液的涂片和培养,以明确诊断。SLE所引起的肺间质性病变主要为处于急性和亚急性期的肺间质磨玻璃样改变和慢性肺间质纤维化,临床表现为活动后气促、干咳、低氧血症,肺功能检查常显示弥散功能下降。少数病情危重者、伴有肺动脉高压者或血管炎累及支气管黏膜者可出现咯血。SLE如出现弥漫性出血性肺泡炎,则死亡率极高。SLE还可出现肺动脉高压、肺栓塞、肺萎缩综合征(shrinking-lung syndrome)。
8.心脏心脏受累可发生在瓣膜、心包、心肌或传导系统等任何部位。SLE患者常出现心包炎,表现为心包积液,但心脏压塞少见。SLE可有心肌炎、心律失常,多数情况下SLE的心肌损害不太严重,但是在重症的SLE,可伴有心功能不全,为预后不良指征。在心脏超声检查中有时可发现二尖瓣或主动脉瓣的疣状心内膜炎(Libman-Sack心内膜炎),病理表现为瓣膜赘生物,应注意其与感染性心内膜炎的区别,疣状心内膜炎瓣膜赘生物最常见于二尖瓣后叶的心室侧,且并不引起心脏杂音性质的改变。通常疣状心内膜炎不引起临床症状,但可以脱落引起栓塞,或并发感染性心内膜炎。冠状动脉受累,可表现为心绞痛和心电图ST-T改变,甚至出现急性心肌梗死。
9.消化系统 SLE可出现恶心、呕吐、腹痛、腹泻或便秘,其中以腹泻较常见,可伴有蛋白丢失性肠炎,并引起低蛋白血症。活动期SLE可出现肠系膜血管炎,其表现类似急腹症,甚至被误诊为胃穿孔、肠梗阻而手术探查。SLE肠系膜血管炎尚缺乏有力的辅助检查手段,腹部CT可表现为小肠壁增厚伴水肿,肠袢扩张伴肠系膜血管强化等间接征象。SLE常见肝酶增高,仅少数出现严重肝损害和黄疸。SLE还可并发急性胰腺炎。
10.其他 SLE的眼部受累包括结膜炎、葡萄膜炎、眼底改变、视神经病变等。眼底改变包括出血、视乳头水肿、视网膜渗出等,视神经病变可以导致突然失明。SLE常伴有继发性干燥综合征,表现为口干、眼干等外分泌腺受累,抗SSA、SSB抗体阳性等。SLE还可并发抗磷脂综合征,表现为动静脉血栓形成、血小板减少、流产等。有的甚至可并发灾难性抗磷脂综合征,表现为短期内(几天到几周)进行性出现大量血栓形成,累及中枢神经系统、肺、肾和心脏等重要器官,并可造成器官衰竭及死亡。
实验室检查及特殊检查1.一般检查 活动期SLE的血细胞三系中可有贫血和/或白细胞减少和/或血小板减少;尿检中出现尿蛋白,红细胞、白细胞、管型尿等。血沉在活动期常增高;而C反应蛋白通常不高,合并感染或关节炎较突出者可出现C反应蛋白明显增高;血清补体C3、C4水平下降,与SLE活动度呈负相关,常可作为病情活动性和治疗反应的监测指标之一。SLE还常出现高γ球蛋白血症。
2.ANAs和其他自身抗体
(1)ANAs:ANAs是自身抗体的一个“家族”。既往认为ANAs是包括一系列针对细胞核中抗原成分的自身抗体。目前广义的ANA的定义是指抗细胞内所有抗原成分的自身抗体的总称。目前将ANAs分为五大类,包括抗DNA抗体、抗组蛋白抗体、抗非组蛋白抗体、抗核仁抗体和抗其他细胞成分抗体。免疫荧光方法检查ANA是SLE的筛选检查。对SLE的诊断敏感性为95%,特异性相对较低为65%。除SLE之外,其他结缔组织病的血清中也常存在ANA,一些慢性感染也可出现低滴度的ANA。因此ANA检测不是诊断SLE的特异性抗体,但是ANA阴性的患者,其诊断SLE的可能性仅为3%。抗双链DNA(dsDNA)抗体对SLE的诊断特异性为95%,敏感性为70%,它与疾病活动性及预后有关,因此,部分患者病情缓解后,其dsDNA抗体可能会消失。抗Sm抗体对SLE的诊断特异性高达99%,但敏感性仅为25%左右,该抗体的存在与疾病活动性无明显关系。抗核糖体P蛋白(rRNP)抗体与SLE的精神症状有关。抗核小体抗体、抗增殖性核抗原抗体也是SLE的特异性抗体。抗单链DNA、抗组蛋白、抗u1RNP、抗SSA和抗SSB等抗体也可出现于SLE的血清中。抗SSA抗体与继发SS、新生儿狼疮有关,但其诊断特异性低,因为这些抗体也见于其他自身免疫性疾病。抗组蛋白抗体与药物性狼疮有关。
(2)其他自身抗体:包括与抗磷脂抗体综合征有关的抗磷脂抗体(包括抗心磷脂抗体和狼疮抗凝物);与溶血性贫血有关的抗红细胞抗体;与血小板减少有关的抗血小板抗体;与神经精神性狼疮有关的抗神经元抗体等。SLE患者还常出现血清RF阳性。
3.病理学检查 SLE的免疫病理学检查包括皮肤狼疮带试验、肾的病理活检等。肾活检对狼疮肾炎的诊断、治疗和预后估计都有价值,尤其对指导治疗有重要意义。
诊断和鉴别诊断1.诊断标准 目前普遍采用ACR1997年修订的SLE分类标准(表2)。SLE分类标准的11项中,符合4项或4项以上者,在除外感染、肿瘤和其他结缔组织病后,可诊断SLE。其敏感性和特异性均较高,分别为95%和85%。11条分类标准中,免疫学异常和高滴度ANA对于诊断更具有意义。一旦患者免疫学异常,即便临床诊断不够条件,也应密切随访,以便尽早作出诊断和及早治疗。

表2 ACR1997年修订的SLE分类标准
2.SLE病情活动性和病情轻重程度的评估
(1)SLE活动性表现:各种SLE新近出现的临床症状,均可提示疾病的活动。国际上通用的几个SLE活动性判断标准包括:SLE病情活动指数(systemic lupus erythematosus disease activity in-dex,SLEDAI)、狼疮活动测量标准(systemic lupus activity measure,SLAM)、欧洲统一狼疮损伤指数(European consensus lupus damage index,ECLAM)和大不列颠群岛狼疮评估组指数(British Isles lupus assessment group,BILAG)。其中以SLEDAI最为常用(表3),其理论总积分为105分,但实际绝大多数患者积分小于45。


表3 SLEDAI积分
(2)SLE病情轻重程度的评估
1)轻型SLE:诊断明确或高度怀疑SLE,表现为原因不明的反复发热,抗炎退热治疗往往无效;多发和反复发作的关节痛/关节炎,往往持续多年而不产生畸形;持续性或反复发作的胸膜炎/心包炎;抗生素或抗结核治疗不能治愈的肺炎;不能用其他原因解释的皮疹/网状青紫/雷诺现象;肾疾病或持续不明原因的蛋白尿;血小板减少性紫癜或溶血性贫血;不明原因的肝炎;反复自然流产或深静脉血栓形成或脑卒中发作,但是病情稳定,呈非致命性;SLE可累及的器官(包括肾、血液系统、肺、心脏、消化系统、中枢神经系统、皮肤、关节)功能正常或稳定;无明显SLE治疗药物的毒副反应。
2)重型SLE:指有重要脏器受累及并影响其功能的情况(表4)。
狼疮危象则是指急性的危及生命的重型SLE。后者常包括急进性狼疮性肾炎、严重的中枢神经系统损害、严重的溶血性贫血、严重的血小板减少性紫癜、严重心脏损害、严重狼疮性肺炎、严重狼疮性肝炎、严重的血管炎等。
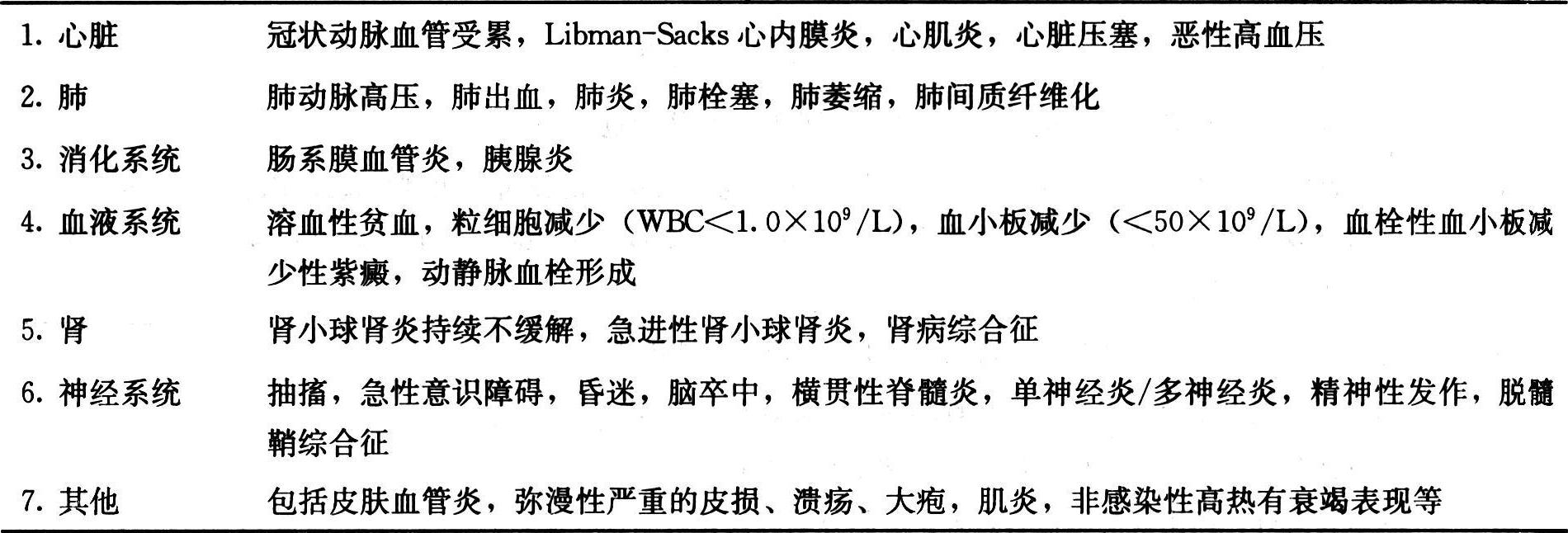
表4 重型SLE
治疗1.一般治疗
(1)健康教育:正确认识疾病,消除恐惧心理,规律用药,长期随访。避免过多的紫外光直接照射,使用防紫外线用品,避免过度疲劳。
(2)对症治疗和去除各种影响疾病预后的因素,如注意控制高血压,防治各种感染等。
2.药物治疗 到目前为止,还没有根治SLE的办法,但恰当合理的治疗可以使大多数患者达到病情缓解。因此强调早期诊断和早期治疗,以避免或延缓不可逆的组织脏器的病理损害。SLE是一种高度异质性的疾病,临床医生应根据病情的轻重程度,既要考虑药物的毒副反应,又要懂得药物的作用机制,掌握好治疗的风险与效益之比,进行个体化治疗。
(1)轻型SLE的治疗:轻型的SLE,虽有狼疮活动,但症状轻微,仅表现光过敏、皮疹、关节炎或轻度浆膜炎,而无明显内脏损害者。可以选择以下治疗药物:
1)非甾类抗炎药(NSAIDs):可用于控制关节炎、肌肉疼痛、发热等。
2)抗疟药:可控制皮疹和减轻光敏感,常用氯喹0.25g/d,或HCQ 0.4g/d,分两次服。主要不良反应是眼底病变,用药前及用药后6个月应检查眼底,有视力明显下降者,应检查眼底,明确原因。另外有心脏病史者,特别是心动过缓或有传导阻滞者禁用抗疟药。
3)小剂量激素(如泼尼松≤10mg/d)可减轻症状。
4)权衡利弊必要时可用AZA、MTX或CTX等免疫抑制剂。
(2)重型SLE的治疗:治疗主要分两个阶段,即诱导缓解和巩固治疗阶段。诱导缓解目的在于迅速控制病情,阻止或逆转内脏损害,力求疾病完全缓解(包括血清学、症状和受损器官的功能恢复),但应注意免疫抑制剂的副作用,尤其是感染、性腺抑制等。多数患者的诱导缓解期需要半年至1年。
1)糖皮质激素:糖皮质激素具有强大的抗炎作用和免疫抑制作用,是治疗SLE的基础用药。糖皮质激素主要是通过与靶细胞胞浆内的糖皮质激素受体(GR)结合,产生信号传递,最终发挥其生物学作用。糖皮质激素可以稳定和延长细胞膜的静止时相,抑制吞噬细胞功能;稳定溶酶体膜,防止溶酶体酶的释放;干扰补体激活,减少炎症介质的产生;抑制炎症细胞的活化;减少炎症组织的粘连及瘢痕形成。因此,糖皮质激素对免疫细胞的许多功能及对免疫反应的多个环节均有抑制作用,尤以对细胞免疫的抑制作用突出,在大剂量时还能够明显抑制体液免疫,使抗体生成减少,超大剂量则可有直接的淋巴细胞溶解作用。由于不同的激素剂量的药理作用有所侧重,病情和患者间对激素的敏感性有差异,临床用药要个体化。一般来说,重型SLE的标准剂量是泼尼松1mg/(kg.d),病情稳定后2~8周内,开始以每1~2周减10%的速度逐渐减量,减至泼尼松0.5mg/(kg.d)后,减药速度可按病情适当调慢;如果病情允许,维持治疗的激素剂量尽量小于泼尼松10mg/d。在减药过程中,如果病情不稳定,可暂时维持原剂量不变或酌情增加剂量或加用免疫抑制剂联合治疗。
2)环磷酰胺(cyclophosphamide,CTX):CTX为氮芥的衍生物,是主要作用于S期的细胞周期特异性烷化剂,抑制T、B淋巴细胞增殖,在治疗早期首先抑制B淋巴细胞;抑制淋巴母细胞对抗原刺激的反应;降低血清免疫球蛋白水平,减少抗体产生和有丝分裂原介导的免疫球蛋白的产生,发挥细胞毒作用。其对体液免疫的抑制作用较强,在狼疮性肾炎和血管炎的患者中,CTX与激素联合治疗是阻止和逆转病变的发展,改善远期预后的首选方案。目前普遍采用的标准CTX冲击疗法是:0.8~1.0g/m2,每3~4周1次。多数患者6~12个月可以缓解病情而进入巩固治疗阶段,还常需要继续CTX冲击治疗,逐渐延长用药间歇期,至约3个月一次维持数年。过去认为CTX累积剂量不应超过9~12g以上,新近的研究提示,CTX累积剂量可以至30g以上,可以使LN的远期疗效更为巩固,且安全性并未由此降低。治疗中应注意避免白细胞过低,一般要求白细胞不低于3.0× 109/L。CTX冲击治疗对白细胞影响有一定规律,一次大剂量CTX进入体内,第3天左右白细胞开始下降,7~14天至低谷,之后白细胞逐渐上升,至21天左右恢复正常。对于间隔期少于3周者,更应密切注意监测血象。大剂量冲击前必须先查血常规。由于CTX的敏感性存在个体差异,治疗时应根据年龄、体质、病情和病程灵活掌握剂量和冲击间隔期。
近年来,国内外研究者对CTX用药方案提出了小剂量冲击的观点。Laurence等的系列研究表明,与CTX 800~1 000mg/m2,每月一次大剂量冲击相比,CTX 400~500mg/m2,每2周一次小剂量冲击,对难治性LN有显著疗效,且不良反应较少。
CTX冲击治疗的副作用主要包括:白细胞减少、诱发感染、性腺抑制(尤其是女性的卵巢功能衰竭)、胃肠道反应、脱发、肝功能损害、出血性膀胱炎,少见远期致癌作用。在应用本品的24h内患者应该多饮水,尽量在早晨用药,以避免含毒性代谢产物的尿液在膀胱中存留。在每天输CTX前4h与最后一次输CTX后6h内大量补液尤为重要,加强利尿,必要时使用呋塞米,使尿量在150~200ml/h,碱化尿液,尿pH维持在7~8。
3)AZA:在控制肾和神经系统病变效果较差,而对浆膜炎、血液系统损害、皮疹等较好。用法1~2.5mg/(kg.d),常用剂量50~100mg/d,分1~2次口服。副作用包括:骨髓抑制、胃肠道反应、肝功能损害等。少数对AZA极敏感者用药短期就可出现严重脱发和骨髓抑制,引起严重粒细胞和血小板缺乏症,轻者停药后血象多在2~3周内恢复正常,重者则需按粒细胞缺乏或急性再障处理以后不宜再用。
4)MTX:主要用于关节炎、肌炎、浆膜炎和皮肤损害为主的SLE。副作用有胃肠道反应、骨髓抑制、口腔溃疡、肝功能损害、脱发、性腺抑制等,偶见MTX导致肺炎和肺间质纤维化。
5)环孢素:可特异性抑制T淋巴细胞IL-2的产生,发挥选择性的细胞免疫抑制作用,是一种非细胞毒免疫抑制剂。对狼疮肾炎有效,可用环孢素3~5mg/(kg.d),分两次口服。用药期间注意肝、肾功能及高血压、高尿酸血症、高血钾等。
6)吗替麦考酚酯:为次黄嘌呤单核苷酸脱氢酶的抑制剂,可抑制嘌呤从头合成途径,从而抑制淋巴细胞活化。吗替麦考酚酯治疗狼疮性肾炎有效,能够有效的控制LN活动。每日剂量10~30mg/kg,分2次口服。
7)生物制剂:抗CD20单抗通过影响B淋巴细胞Ca2+的跨膜传导而调节B淋巴细胞增殖和分化,抑制B淋巴细胞的成熟和分化。可以使部分难治性重症SLE患者得到临床缓解,且耐受性好。
(3)狼疮危象的治疗:治疗目的在于挽救患者生命、保护重要脏器、防止后遗症。通常需要大剂量甲泼尼龙(methylprednisolone,MP)冲击(MP 1 000mg/d静脉注射,应用3~5天)及静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)冲击治疗,同时针对受累脏器给予对症和支持治疗,随后给予诱导缓解和维持巩固治疗。
1)急进性肾小球肾炎:临床表现为急进行性少尿、水肿、蛋白尿、血尿,低蛋白血症、贫血,肾功能进行性下降、血压升高、高血钾、代谢性酸中毒等。B超示肾脏体积常增大,肾脏病理往往呈新月体肾炎。治疗包括纠正水电解质酸碱平衡紊乱,低蛋白血症,防治感染,纠正高血压,心力衰竭等合并症,保护重要脏器,必要时需要透析支持治疗。在评估SLE活动性和全身情况和有无治疗反指征的同时,应抓紧时机肾穿,判断病理类型和急慢性指标,制订治疗方案。对明显活动、非肾脏纤维化/硬化等不可逆病变为主的患者,应积极使用激素[泼尼松≥2mg/(kg.d)],必要时可使用大剂量MP冲击疗法。亦可加用CTX冲击治疗。
2)神经精神狼疮:弥漫性神经精神狼疮在控制SLE的基础药物上强调对症治疗,包括抗精神病药物(与精神科医生配合),癫痫大发作或癫痫持续状态时需积极抗癫痫治疗,注意加强护理。ACL相关神经精神狼疮,应加用抗凝、抗血小板聚集药物。有全身血管炎表现的明显活动证据,应用大剂量MP冲击治疗。中枢狼疮包括横贯性脊髓炎在内,可试用地塞米松加MTX鞘内注射治疗,每周1次,共2~3次。
3)重症血小板减少性紫癜:血小板<20× 109/L,有自发出血倾向,常规激素治疗无效[1mg/(kg.d)]时,应加大激素用量用至2mg/(kg.d)以上。还可静脉滴注长春新碱(VcR)1mg,qw×(3~6)次。重症者可给予静脉输注大剂量人体免疫球蛋白(IVIG)0.4g/(kg.d),连续3~5天为1个疗程。无骨髓增生低下的重症血小板减少性紫癜还可试用其他免疫抑制剂,如CTX、环孢素等。其他药物包括达那唑、他莫昔芬、维生素C等,如内科保守治疗无效,可考虑脾切除术。
4)弥散性出血性肺泡炎和急性重症肺间质病变:部分弥散性出血性肺泡炎的患者起病可无咯血,支气管镜有助于明确诊断。本病极易合并感染,常同时有大量蛋白尿,预后很差,死亡率极高。可给予大剂量MP冲击治疗,IVIG,血浆置换等。
5)严重的肠系膜血管炎:治疗目的为加强肠外营养支持,防治合并感染,避免不必要的手术、探查。应使用2mg/(kg.d)以上激素控制病情,同时注意水电解质酸碱平衡,一旦并发肠坏死、穿孔、中毒性肠麻痹,应及时手术治疗。
3.特殊治疗血浆置换、免疫吸附等方法可以辅助治疗SLE,取得一定的疗效,尤其是免疫吸附对难治性SLE疗效肯定。值得注意的是免疫吸附必须联合免疫抑制剂治疗才能取得良好的远期效果,因此不能滥用。造血干细胞移植(hematopoietic stem cell transplantation,HSCT)不失为部分难治性SLE患者的一种治疗选择。
4.SLE合并抗磷脂综合征目前认为APS的治疗原则是在治疗原发病的基础上进行对症处理及防治血栓和流产的再发,原发性APS一般不需要大剂量激素治疗,除非合并有血小板减少和溶血性贫血等特殊情况。对抗体阳性无症状的患者无需抗凝治疗,但可用药预防血栓的发生。常用药物有华法林、阿司匹林、肝素或低相对分子质量肝素(LMWH)、HCQ等。灾难性抗磷脂综合征除了抗凝治疗外,联合激素、CTX、血浆置换和大剂量丙种球蛋白治疗以降低或去除抗体,可提高患者的生存率。
5.妊娠生育SLE对妊娠的不良影响主要表现为异常妊娠,常见的有流产、早产、死产及胎儿宫内营养不良所致宫内胎儿发育迟缓,但大多数SLE患者在疾病控制后,可以安全地妊娠生育。患者病情缓解稳定1年后,泼尼松维持量小于10mg/d,停用细胞毒药物(如AZA、CTX、MTX等)6个月以上,无重要脏器病变,可考虑允许妊娠。活动性肾脏病变或血肌酐高于176.8μmol/L,均属妊娠禁忌证,合并心包、心脏、肺严重病变的患者也不宜妊娠。对于有习惯性流产病史和抗磷脂抗体阳性的孕妇,主张口服小剂量阿司匹林(100mg/d),和/或小剂量肝素抗凝,防止流产或死胎。
预后 与过去相比,SLE的预后已显著提高。5年存活率可达到90%,10年存活率可达到80%。急性期患者的死亡原因主要是SLE的多脏器严重损害和感染,尤其见于狼疮性肾炎和神经精神性狼疮,慢性肾功能不全和药物(尤其是长期使用大剂量激素)的副反应以及冠状动脉粥样硬化性心脏病、感染等,是SLE远期死亡的主要原因。血肌酐浓度进行性增高、持续性蛋白尿(≥3.5g/24h)及血尿、贫血、高血压、肾脏病理慢性指数高等是狼疮性肾炎预后不良的指征。
处置建议
病情评估/分型治疗原则
一般治疗
特殊器官受累的治疗 狼疮性肾炎、神经精神狼疮等特殊器官受累的治疗详见相关内容
狼疮危象的治疗
其他治疗病情危重或治疗困难病例,可根据临床情况选择静脉注射大剂量免疫球蛋白、血浆置换、造血干细胞或间充质干细胞移植以及belimumab(anti-BAFF)抗体、抗CD20单抗(利妥昔单抗)生物制剂等
妊娠一般在无重要脏器损害、病情稳定1年或1年以上,细胞毒免疫抑制剂(环磷酰胺、甲氨蝶呤等)停药半年,激素仅用小剂量维持时(≤10mg/d)方可怀孕
SLE患者妊娠后,需要产科和风湿科医生双方共同随访诊治
妊娠后能应用泼尼松龙治疗,免疫抑制剂可选用羟氯喹或硫唑嘌呤
产后避免哺乳
用药建议
非甾体抗炎药抗疟药
糖皮质激素
免疫抑制剂
合并抗磷脂抗体综合征的治疗
检查建议
一般检查
自身抗体
抗核抗体谱:95%的SLE患者出现抗核抗体(ANA)阳性;抗双链DNA(dsDNA)抗体的特异性95%,与疾病活动性及预后有关; 抗Sm抗体的特异性达99%,是SLE的标志性抗体,与疾病活动性无明显关系;抗核糖体P蛋白(rRNP)抗体往往提示有神经精神狼疮或其他重要内脏的损害;抗单链DNA、抗组蛋白、抗u1RNP、抗SSA抗体和抗SSB抗体等也可出现于SLE患者的血清中
抗磷脂抗体:包括抗心磷脂抗体、狼疮抗凝物、抗β2-糖蛋白1(β2GP1)抗体、梅毒血清试验假阳性等对自身不同磷脂成分的自身抗体。结合其特异的临床表现可诊断是否合并有继发性抗磷脂抗体综合征
抗组织细胞抗体:抗红细胞膜抗体,现以Coombs试验测得。抗血小板相关抗体导致血小板减少,抗神经元抗体多见于神经精神狼疮
少数患者血清可出现类风湿因子和抗中性粒细胞胞浆抗体
补体
病情活动度指标
肾活检病理
影像学检查
其他检查
患者指导
随访治疗后的定期规律随访对防止复发和减少并发症非常重要
轻症患者或维持治疗的患者应每3个月随访1次,稳定期的患者可以6-12个月随访1次,但是重症诱导缓解期则建议每月随访,包括SLE血清学检查、器官功能评估以及治疗药物不良反应检测等
随访中应充分重视并发症的防治,包括骨质疏松、股骨头坏死、肺动脉高压以及动脉粥样硬化等
预后









