疾病详情
定义糖尿病 (diabetes m ellitus,DM ) 是一种由多种病因引起的代谢性疾病,由于胰岛素分泌 和(或)作用缺陷导致慢性高血糖伴碳水化合物、脂肪和蛋白质代谢紊乱。糖尿病的慢性高血糖可引起长期多系统(尤其是眼、肾脏、神经、心脏和血管)的损害、功能减退及衰竭;严重时可发生急性代谢紊 乱,如糖尿病酮症酸中毒 (D K A )、非酮症性高渗状态等。
糖尿病的发生过程包含了多种发病机制。胰岛素分泌不足和(或)靶器官对胰岛素反应减弱导致胰岛素在靶器官的作用缺陷是导致代谢紊乱的基础。
随着人们生活方式的改变以及人口老化,全球的糖尿病的患病率迅速增加。据世界卫生组织(WHO)估计,到2025年,全球糖尿病患者将从1995年的1.35亿增加到3亿。我国1979-1980年调查成人糖尿病患病率为1 %;1994-1995年调查成人糖尿病患病率为2.5%;2000-2001年调查成人糖尿病患病率为5.5%;2007-2008年调查成年糖尿病患病率已达9.7%。糖尿病已成为严重威胁人类健康、造成巨大的社会经济负担的公共卫生问题。
糖尿病分型1999年WHO糖尿病专家委员会提出了糖尿病的分型标准:
1.1型糖尿病(T1DM)胰岛β细胞破坏,有酮症酸中毒倾向,占糖尿病中的5%~10%。
(1)自身免疫性:急性型及缓发型。
(2)特发性:病因学及病理生理学过程不详。
2.2型糖尿病(T2DM)主要类型是以胰岛素抵抗为主伴胰岛素分泌缺陷,占糖尿病中的90%~95%。
3.其他特殊类型糖尿病
(1)β细胞的基因缺陷:①β细胞功能的单基因缺陷,常表现为青年发病的高血糖,即青年人中的成年发病型糖尿病(maturity-onset diabetes mellitus of the young,MODY)。在目前发现的6种亚型中,最常见的类型是12号染色体上肝细胞核因子1α(HNF-1α)基因突变(MODY3);其次是发生于7号染色体短臂上的葡萄糖激酶基因突变(MODY2);少见类型见于其他转录因子的基因突变,包括:肝细胞核因子4α(HNF-4α)、肝细胞核因子1β(HNF-1β)、胰岛素启动子(IPF)-1和神经源性分化因子1(Neuro D1)的基因突变,分别命名为MODY1,MODY5、MODY4和MDY6。②线粒体基因突变糖尿病,最常见的类型是tRNA Leucine基因3243位点的A→G突变。
(2)胰岛素作用的基因缺陷:胰岛素受体基因突变,Leprechaunism综合征、Rabson-Menden-hall综合征以及伴胰岛素抵抗的脂肪萎缩型糖尿病。
(3)胰腺外分泌疾病:胰腺炎、创伤、胰腺切除术、感染、胰腺癌等。
(4)内分泌病:拮抗胰岛素作用的激素分泌过多的疾病,包括:肢端肥大症、库欣综合征、胰高糖素瘤、嗜铬细胞瘤。生长抑素瘤和醛固酮瘤引起的低钾血症可抑制胰岛素分泌而导致糖尿病。
(5)药物或化学品所致糖尿病:毒鼠药Vacor和抗寄生虫药物喷他脒可永久破坏β细胞。烟酸和糖皮质激素导致胰岛素作用受损。其他药物包括:甲状腺激素、二氮嗪、β肾上腺素受体激动剂、噻嗪类利尿药、苯妥英钠、α-干扰素等。
(6)感染:先天性风疹、柯萨奇病毒B、巨细胞病毒、腺病毒、腮腺炎病毒等。
(7)不常见的免疫介导糖尿病:僵人(stiff-man)综合征、抗胰岛素受体抗体导致的糖尿病等。
(8)其他与糖尿病相关的遗传综合征:Down综合征、Klinefelter综合征、Turner综合征、Wolfram综合征等。
4.妊娠糖尿病(GDM)妊娠期间发现的任何程度的葡萄糖不耐受。
糖尿病高危状态在达到糖尿病诊断标准之前,糖尿病患者会经历一个血糖高于正常的过程,称为“葡萄糖调节受损”(IGR)或“糖尿病前期”,包括空腹血糖受损(IFG)和(或)葡萄糖耐量受损(IGT)。在糖尿病高危人群中进行积极的生活方式干预可以预防或延缓糖尿病的发生。
病因和发病机制虽然糖尿病的病因和发病机制至今尚未完全阐明,但目前已知遗传因素及环境因素是糖尿病发病的重要病因。
(一)1型糖尿病
绝大多数T1DM是自身免疫性疾病,患者体内可以检测到多种自身抗体,包括胰岛细胞自身抗体、胰岛素自身抗体、GAD自身抗体、酪氨酸激酶IA-2和IA2β自身抗体等。1型糖尿病与HLA DQA和HLA-DQB基因关联,并且受HLA-DRB基因影响。这些等位基因与1型糖尿病的发病起伏进或保护作用。环境因素包括某些病毒感染诱发自身免疫反应、和饮食因素(如缺乏母乳喂养)等,
(二)2型糖尿病
T2DM遗传因素和环境因素共同作用的结果,目前所定义的T2DM仍存在异质性。T2DM是灸基因遗传病,其参与发病的基因及其在对发病的影响程度尚未完全明确。在遗传易感性的背景下,髓着年龄的增加、饮食中过多碳水化合物和脂肪类的摄入以及缺乏体力活动所引起的肥胖,都可促进T2DM的发病。
病理生理学机制参与糖尿病发病的主要病理生理学机制包括胰岛素抵抗和β细胞功能缺陷。
1.胰岛素抵抗 指胰岛素作用的靶器官(主要是肝脏、肌肉和脂肪组织)对胰岛素作用的敏感性降低,从而减弱胰岛素降低机体血糖的作用。以胰岛素抵抗为主的T2DM患者多伴有肥胖,肥肝即可导致一定程度的胰岛素抵抗。
2.β细胞功能缺陷 T2DM早期,患者胰岛素水平往往正常或者升高,这是因为胰岛β细胞为代偿胰岛素抵抗而分泌胰岛素增加,但胰岛素的分泌量仍低于同等胰岛素抵抗条件下正常人的胰岛素分泌。随着血糖水平的增加,β细胞分泌胰岛素逐渐降低。
临床表现(一)代谢紊乱的表现
高血糖引起渗透性利尿,患者表现为多尿且夜尿增多明显、口渴、多饮;由于葡萄糖利用障碍脂肪和蛋白质分解增多,患者表现为体重下降和消瘦,乏力,消瘦,易饥,多食,儿童生长发育观阻。女性可因真菌性阴道炎出现外阴瘙痒。血糖升高较快的患者因晶体渗透压改变而引起屈光改变而出现视力模糊。血糖升高缓慢的患者往往无任何症状,仅于检测血糖时发现糖尿病。
一般而言,在自身免疫性T1DM中,青少年患者往往起病急且症状重,严重者以酮症酸中毒昏迷就诊;而成人隐匿性自身免疫性糖尿病(latent autoimmune diabetes in adults,LADA)患者起病相对缓慢,体型多正常或消瘦,发病后很快需要用胰岛素控制血糖。
T2DM多见于成年人,发病缓慢,症状轻或无症状。有时以糖尿病慢性并发症就诊。早期不需要胰岛素治疗,随着病程进展,最后发展为需要胰岛素治疗。T2DM患者常有糖尿病家族史,伴有肥胖、血脂异常、高血压等代谢综合征表现。
(二)并发症和伴发病的表现
参见下文。
并发症(一)急性严重代谢紊乱
包括糖尿病酮症酸中毒和高血糖高渗状态。
(二)感染
皮肤感染包括疖、痈、足癣等。女性常见真菌性阴道炎及尿路感染,男性可发生龟头炎。糖尿病合并肺结核的发生率较非糖尿病者高。
(三)慢性并发症
高血糖引起的氧化应激是糖尿病慢性并发症发生的重要机制。主要的慢性并发症包括大血管病变和微血管病变。
1.以动脉粥样硬化为特征的糖尿病大血管病变 主要表现为冠心病、缺血性或出血性脑血管病、肾动脉硬化、外周动脉硬化等。
2.微血管病变 包括糖尿病肾病、视网膜病变和糖尿病神经病变。
(1)糖尿病肾病:是T1DM患者的主要死亡原因,随着糖尿病病程的延长,糖尿病肾病的发病率增高。但是,糖尿病肾病的发生还与遗传因素有关。T1DM肾损害的发生、发展可分五期,目前T2DM肾病沿用该分期:①I期:肾体积增大,肾小球滤过率(GFR)升高,严格控制血糖可使肾小球滤过率接近正常。②Ⅱ期:此期尿白蛋白排泄率间歇性增高(如运动后、应激状态),GFR轻度增高。③Ⅲ期:隐性糖尿病肾病,T1DM发病5年后可出现微量白蛋白尿,即尿白蛋白排泄率(UAER)持续在20~200μg/min(正常<10μg ),相当于尿白蛋白 /肌酐比率 30~299pg/m g ,GFR 正常或高于正常,血压逐渐升高。④Ⅳ期:临床肾病,出现大量白蛋白尿,U AER >200μg/min,相当于尿白蛋白/肌酐比率≥300μg/mg或尿蛋白总量>0.5g/24h,GFR下降。⑤V期:尿毒症,UAER降低,血肌酐升高,血压升高。
(2)糖尿病性视网膜病变:是20~74岁人群中失明的主要原因之一。视网膜改变可分为六期,分属两大类。I期:微血管瘤、出血点;Ⅱ期;硬性渗出;Ⅲ期:软性渗出。Ⅰ~Ⅲ期称为为背景性视网膜病变。Ⅳ期:新生血管形成、玻璃体积血;V期:纤维血管增殖、玻璃体机化;Ⅵ期:牵拉性视网膜脱离和失明。Ⅳ~Ⅵ期称为增殖性视网膜病变(PDR)。
(3)糖尿病性神经病变(图1):常见的有周围神经病变和自主神经病变。周围神经病变表现为对称性肢端感觉异常、痛觉过敏,肌力减弱、腱反射减弱、音叉震动感减弱或消失。体感诱发电位可发现无症状的感觉和运动神经传导速度减慢。自主神经病变可影响消化系统,表现为排汗异常(无汗、少汗或多汗),胃排空延迟(胃轻瘫),腹泻和便秘交替等;影响到心血管系统,表现为直立性低血压、心动过速、心率变异性降低等;影响到泌尿生殖系统,表现为残尿量增加、尿失禁、尿潴留、阳痿等。
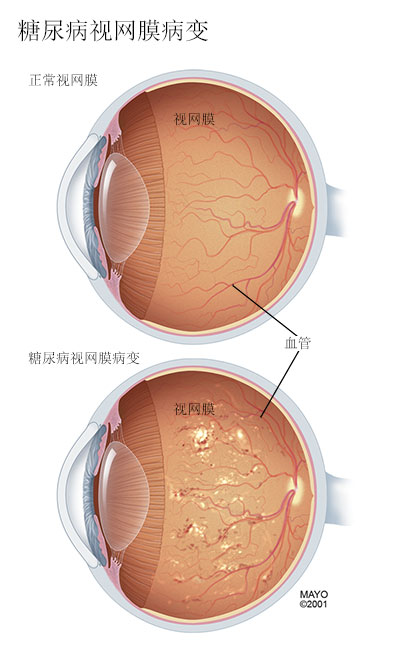
图1
3.糖尿病足 是非创伤性截肢的重要原因之一,由下肢神经病变、血管病变和感染共同导致。严重者表现为足部溃疡和坏疽。
实验室检查(一)糖尿病的诊断和血糖的控制情况
1.尿糖测定 尿葡萄糖阳性是诊断糖尿病的线索之一,正常人血糖10mmol/L以上时出现尿糖阳性(肾糖阈),因此可以用尿糖定性判断血糖的高低。但是,肾糖阈升高(如肾脏疾病)或降低(如妊娠)都会影响通过尿糖对血糖水平的判断,因此尿糖定性不能作为糖尿病的诊断标准。
2.口服葡萄糖耐量试验(OGTT) 测定血糖是诊断糖尿病的“金标准”。血糖值反映的是瞬间血糖状态,常用葡萄糖氧化酶法测定。糖尿病诊断需测定静脉血浆血糖,糖尿病治疗过程中可以通过毛细血管血糖测定了解血糖控制情况。
OGTT应在清晨空腹8~14小时后进行,成人口服溶于250~300ml水中的75g无水葡萄糖或82.5g一水葡萄糖,5分钟内饮完;儿童服糖量按每公斤体重1. 75g计算,总量不超过75g。分别于空腹及开始饮葡萄糖水后2小时测静脉血浆葡萄糖。
3.糖化血红蛋白(HbA1)和糖化血清白蛋白 HbA1是葡萄糖与血红蛋白的氨基发生非酶催化反应的产物,HbA1C(A1C)是最为主要的糖化血红蛋白,由于红细胞的寿命约为120天,因此AlC反映患者近8~12周的平均血糖水平。不同实验室之间其参考值有一定差异,一般为4%~6%。A1C是糖尿病控制情况的主要监测指标,随着A1C水平的增高,糖尿病并发症的发生风险增加。最近,ADA(2010)提出将A1C≥6.5%作为糖尿病的诊断标准之一。血清白蛋白也可与葡萄糖发生非酶催化的糖化反应糖化白蛋白,白蛋白半衰期为19天,故糖化白蛋白反映了患者近2~3周内总的血糖水平。
(二)胰岛β细胞功能检查
血糖的水平直接反映了胰岛β细胞的功能,高血糖提示胰岛β细胞功能的降低。此外,在OGTT试验中测定多个时间点的胰岛素和C肽水平有助于评估胰岛β细胞功能。
1.胰岛素释放试验 正常人空腹基础血浆胰岛素为35~145pmol/L(5~20mU/L),口服75g无水葡萄糖后,胰岛素在30~60分钟上升至高峰,峰值为基础值5~10倍,3~4小时恢复到基础水平。
2.C肽释放试验 基础值约400pmol/L,30~60分钟出现高峰,峰值为基础值5~6倍。C肽测定不受外源性胰岛素的影响,可用于正在使用胰岛素的患者β细胞功能的检查。
(三)并发症检查
包括血脂、肝肾功能、心脏、肝、肾、眼底及神经系统的检查。血糖明显升高时需进行酮体、电解质、血气分析等检查。
(四)自身抗体的检查
GAD抗体、胰岛细胞自身抗体、胰岛素自身抗体等检测有助于糖尿病分型。
诊断与鉴别诊断(一)诊断
当患者主诉某些症状如口渴、尿量增多、反复感染、体重降低时,应考虑到糖尿病的可能并进行空腹和糖负荷后2h血糖的测定。
WHO糖尿病专家委员会提出的糖尿病和IGR诊断标准(1999)如下:
1.糖尿病诊断是基于空腹(FPG)、任意时间或OGTT中2小时血糖值(2hPG)。空腹指至少8小时内无热量摄入。任意时间指一日内任何时间,无论上一次进餐的时间。OGTT采用75g无水葡萄糖负荷。糖尿病症状指多尿、口渴和难以解释的体重下降。
2.FPG≥7.0mmol/L(126mg/dl),或OGTT 2h PG≥11.1mmol/L(200mg/dl),或糖尿病症状加任意时间血浆葡萄糖≥11.1mmol/L(200mg/dl)应诊断糖尿病。当没有显著的高血糖时,上述标准需在另一天重复一次以确定糖尿病的诊断。
3.FPG 6.1~6.9mmol/L(110~125mg/dl)诊断为IFG;OGTT 2hPG 7.8~11.0mmol/L(140~199mg/dl)诊断为为IGT。
4.儿童糖尿病诊断标准与成人相同。
(二)鉴别诊断
需鉴别T1DM和T2DM,根据发病年龄、起病缓急、症状轻重、酮症酸中毒倾向、是否超重或肥胖、是否依赖胰岛素治疗、是否有糖尿病家族史,结合自身抗体检测进行鉴别。
继发性于肢端肥大症(或巨人症)、库欣综合征、嗜铬细胞瘤等内分泌疾病的糖尿病,具有特殊的症状和体征,一般不难鉴别。
治疗糖尿病的治疗目标包括消除症状、防止或延缓并发症的发生,降低病死率,提高患者生活质量。糖尿病的治疗原则包括:医学营养治疗、运动疗法、血糖监测、药物治疗和糖尿病教育。糖尿病的治疗是综合治疗,除严格控制血糖外,要积极调节血脂紊乱、严格控制血压、抗血小板治疗、控制体重、限制饮酒和戒烟。
(一)糖尿病健康教育
包括对糖尿病对医务人员、患者及其家属的教育。应让患者和家属了解糖尿病的危害和糖尿病并发症的防治知识,学会自我监测血糖、饮食和运动治疗的方法、胰岛素注射的方法、足部的检查和护理,低血糖的预防和处理等。
(二)医学营养治疗
医学营养治疗(medical nutrition therapy,MNT)是糖尿病治疗的基础。
1.计算总热量 用简易公式计算理想体重[理想体重(kg)=身高(cm)-105],根据理想体重和日常活动,计算每日所需总热量。成年人休息状态下维持体重所需的热量是每日每公斤理想体重25~30kcal,如果肥胖的糖尿病患者达到减轻体重的目的,每天摄入的热量应在此基础上减少500kcal,每月体重应减轻2~4kg。随着体力活动的增加,摄入的热量酌情增加。儿童、孕妇、乳母、营养不良和消瘦以及伴有消耗性疾病者应酌情增加。
2.碳水化合物饮食应占总热量的50%~60%。蛋白质摄入量成人每日每公斤理想体重0.8~1. 2g,儿童、孕妇、乳母、营养不良或伴有消耗性疾病者增至1.5~2.0g,伴有糖尿病肾病而肾功能正常者应限制至008g,血肌酐升高者应限制在0.6g。脂肪约占总热量30%。
3.按每克糖类、蛋白质产热4kcal,每克脂肪产热9kcal,将热量换算为食品后制订食谱,可按每日三餐分配为1/5、2/5、2/5或1/3、1/3、1/3。
(三)体育锻炼
规律的体育锻炼有助于减轻体重和改善胰岛素抵抗、改善高血压和血脂紊乱。运动时应注意预防低血糖反应。
(四)血糖和并发症监测
定期监测血糖,建议使用胰岛素治疗的患者应用便携式血糖计进行自我监测血糖(SMBG)。每3个月复查A1C,了解血糖控制的平均水平以及时调整治疗方案。每年进行1~2次并发症的评估。(五)口服药物治疗
1.磺脲类和格列奈类
(1)磺脲类(sulfonylureas,SUs):第一代SUs如甲苯磺丁脲(tolbutamide,D-860)、氯磺丙脲(chlorpropamide)等已很少应用;第二代SUs有格列本脲(glibenclamide)、格列吡嗪(glipiz-ide)、格列齐特(gliclazide)、格列喹酮(gliquidone)和格列美脲(glimepiride)等。
SUs的主要作用为刺激胰岛β细胞分泌胰岛素,其作用部位是胰岛β细胞膜上的ATP敏感的钾离子通道(KATP)。
1)适应证:应用于新诊断的T2DM非肥胖患者,与其他作用机制不同的口服降糖药联合应用。15%~20%的患者治疗反应不佳,为原发失效;初始治疗有效者以每年5%~10%的速度发生继发失效。
2)禁忌证:T1DM,需要胰岛素治疗的T2DM,孕妇、哺乳期妇女,应激状态需要胰岛素治疗者,对SUs过敏或有严重不良反应者等。
3)不良反应:最主要的不良反应为低血糖反应;其他包括体重增加、胃肠道反应等。
(2)格列奈类:此类药物也作用在KATP,结合位点与SUs不同,作用快速,低血糖发生率较磺脲类药物低。包括瑞格列奈(repaglinide)和那格列奈(nateglinide)。禁忌证与SUs相同。于餐前口服。
2.双胍类(biguanides)
包括苯乙双胍和二甲双胍。二甲双胍是目前治疗T2DM的一线用药,用于肥胖或体重指数正常的T2DM患者。目前应用的二甲双胍是通过激活一磷酸腺苷活化的蛋白激酶(AMPK)起效。单独用药一般不引起低血糖。
(1)适应证:无消瘦的T2DM患者一线用药,可单独使用或联合其他药物使用。此外,可用于胰岛素治疗的T1DM患者。
(2)禁忌证:①缺氧性疾病或状态,如心功能不全、COPD;②血清肌酐在133μμmol/L以上者;③糖尿病需要胰岛素治疗者,不单独使用本药;④对药物过敏或有严重不良反应者。
(3)不良反应:胃肠道反应最为常见,最严重的副作用为乳酸性酸中毒,二甲双胍罕见。
3.噻唑烷二酮类(thiazolidinediones,TZDs)
通过激活过氧化物酶体增殖物激活受体γ(PPARγ)起作用。主要的副作用包括水肿、心力衰竭和骨折。不用于心功能不全的患者。主要的药物包括罗格列酮(rosiglitaZOne)和吡格列酮(pioglitazone),前者由于对心血管系统的副作用现已少用。
4.α葡萄糖苷酶抑制剂
小肠黏膜刷状缘的α葡萄糖苷酶将食物中的多糖和双糖分解为葡萄糖,葡萄糖再由小肠吸收。α葡萄糖苷酶抑制剂通过抑制α-葡萄糖苷酶,从而延缓碳水化合物吸收,降低餐后高血糖。常见的副作用为胃肠道反应,如腹胀和排气增多。单独应用不引起低血糖。不宜用于有胃肠道疾病者、孕妇、哺乳期妇女和儿童。包括阿卡波糖(acarbose):主要抑制α-淀粉酶;以及伏格列波糖:主要抑制麦芽糖酶和蔗糖酶。
5.DPP-4抑制剂和GLP-1类似物
GLP-1是位于消化道的胰高糖素样多肽-1,具有葡萄糖依赖的刺激胰岛素分泌的作用。天然的GLP-1半衰期短,在肠道很快被二肽基肽酶(DPP-4)分解。DPP-4抑制剂抑制了DPP-4,延长了天然GLP-1的作用时间,目前上市的有西格列汀(sitaglip-tin),口服给药。GLP-1类似物通过改变氨基酸种类或序列延长半衰期,需皮下注射给药,目前上市的包括艾塞那肽(exenatide)和利拉鲁肽(1iraglutide)。
(六)胰岛素治疗
1.适应证 ①TlDM;②糖尿病急性并发症:糖尿病酮症酸中毒、高血糖高渗状态和乳酸性酸中毒;③各种严重的糖尿病慢性并发症;④手术、妊娠和分娩;⑤T2DM β细胞功能明显减退者。
2.不良反应 最主要的不良反应是低血糖反应,其他包括过敏反应、皮下脂肪萎缩。注射初期,由于晶状体屈光度改变,可出现暂时的视物模糊,多见于治疗开始时血糖较高的患者。
3.胰岛素 其制剂按作用起效快慢和维持时间,胰岛素制剂可分为短效、中效和长效三类。短效胰岛素皮下注射后30分钟起效,高峰时间在注射后2~4小时,持续时间短,约6~8小时,主要用于控制餐后血糖。短效胰岛素是唯一可经静脉注射的胰岛素,亦可用于持续皮下胰岛素输注(con-tinuous subcutaneous insulin infusion,CSII)。低精蛋白胰岛素(neutral protamineHagedorn,NPH,中性精蛋白胰岛素)是中效胰岛素,用以控制空腹血糖,皮下注射后1~3小时起效,高峰时间在注射后6~8小时,持续时间短,约16~18小时。长效胰岛素制剂来源于猪胰岛素。中效胰岛素和短效胰岛素按一定比例混合(70:30或50:50)成为预混胰岛素制剂,优点是注射次数减少,每日2次注射即可覆盖全天的基础胰岛素和餐时胰岛素的补充,缺点是由于睡前的NPH在预混制剂中需要提前至晚餐前注射,夜间低血糖的发生率增加。按照来源,胰岛素制剂包括基因重组人胰岛素和猪胰岛素。人胰岛素比动物来源的胰岛素较少引起免疫反应。胰岛素类似物是通过改变氨基酸序列或种类,从而改变胰岛素作用特性的制剂,包括:
(1)速效胰岛素类似物:赖脯胰岛素(insulin lispro)和门冬胰岛素(insulin aspart),于进餐前注射,起效快、作用时间短。
(2)长效胰岛素类似物:包括甘精胰岛素(insulin glargine)和地特胰岛素(Detemir),主要用于控制空腹血糖,由于几乎没有峰值,低血糖发生率较NPH低。
4.胰岛素使用应根据患者体重和血糖水平,从小剂量开始,逐渐调整剂量。
(1)1型糖尿病:患者由于胰岛β细胞功能差、患者相对年轻,应采用每日3~4次的强化胰岛素治疗,即三餐前皮下注射短效胰岛素(或速效胰岛素类似物),睡前注射中效胰岛素(或长效胰岛素类似物)。部分T1DM患者在胰岛素治疗后一段时间内病情部分或完全缓解,胰岛素剂量减少甚至停用,称为“蜜月期”,通常持续数周至数月。
(2)2型糖尿病:胰岛素仅作为补充治疗,用于病程较长,口服药物继发失效的患者。部分2型糖尿病患者起病时血糖明显增高,伴有或不伴有酮症,也可先进行胰岛素强化治疗,血糖控制后,高血糖对胰岛β细胞的毒性作用接触,自身胰岛β细胞功能部分恢复,再换用口服降糖药物治疗。胰岛素补充治疗的方案可以为每天1次睡前NPH皮下注射,或1~2次预混制剂早、晚餐前注射,对于病程长、年龄大的2型糖尿病患者,由于多存在心脑血管并发症,对低血糖感知差,血糖不宜控制过于严格,可采用此类胰岛素补充治疗方案。对于血糖控制差的年轻患者可考虑每日多次胰岛素强化治疗。
部分患者胰岛素治疗后空腹血糖仍高,可能的原因为:①夜间胰岛素作用不足,需增加睡前胰岛素剂量;②“黎明现象”(dawn phenomenon):夜间血糖控制良好,仅于黎明短时间内出现高血糖,一般认为是清晨皮质醇、生长激素等胰岛素拮抗素激素分泌增多所致,轻者可提前早餐前皮下胰岛素注射及早餐,重者需持续皮下胰岛素输注(CSII)治疗;③Somogyi效应:夜间发生低血糖,体内胰岛素拮抗素激素分泌增加,清晨出现低血糖后的高血糖反应,此时应减少睡前胰岛素的注射剂量。对空腹血糖增高的患者进行夜间0点及3点的血糖监测有助于了解高血糖的原因并进行治疗方案的调整。
CSII是采用胰岛素泵控制胰岛素的输注速度,胰岛素泵(图2)通过导管向腹部皮下持续泵入短效胰岛素。目前已有在腹部皮下同时置入血糖感受装置,实时通过动态血糖监测调整胰岛素输注剂量。胰岛素泵安装后需定期消毒针头置入部位和更换导管和针头。
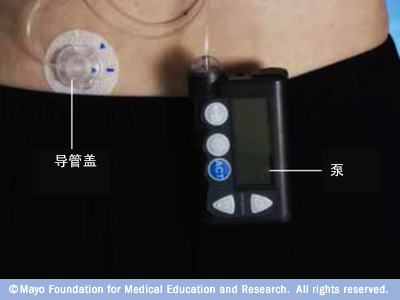
图2胰岛素泵
(七)糖尿病慢性并发症的防治原则
预防糖尿病慢性并发症的重要原则是综合治疗,积极控制多种大血管病变和微血管病变的危险因素,除控制血糖外,要严格控制血压、调节脂代谢紊乱、抗血小板治疗(例如阿司匹林)、控制体重、戒烟和限制饮酒。糖尿病高血压、血脂紊乱和大血管病变的治疗原则与非糖尿病患者相似,但控制要求更为严格。糖尿病患者血压应控制在130/80mmHg以下,如尿蛋白排泄量达到1g/24h,血压应控制低于125/75mmHg,治疗过程中要避免过快降压导致器官灌注不足。糖尿病患者LDL-C治疗应控制在<2.6mmol/L(100mg/dl)。糖尿病肾病患者良好的血糖和血压控制可延缓GFR的下降速度,早期肾病应用血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体阻滞剂(ARB)除可降低血压外,还可减轻微量白蛋白尿;大量白蛋白尿期(Ⅳ期)要开始低蛋白饮食,肾功能正常的患者,饮食蛋白量为每天每公斤体重0.8g,GFR下降后进一步减至0.6g,加用复方α-酮酸。糖尿病眼底病变应由专科医生筛查和治疗,必要时应用激光光凝治疗,争取保存视力。血糖和血压的良好控制有助于预防和延缓糖尿病神经病变,教育患者保护和每天检查足部有助于预防和控制糖尿病足的发生发展。
预防在各级政府机构的领导和公共卫生机构的组织下,在专科医师的支持和参与下,共同对全社会进行糖尿病知识的宣教工作。向全社会宣传健康的生活方式,在糖尿病高危人群中通过积极的生活方式干预预防糖尿病的发生。
糖尿病酮症酸中毒糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)为最常见的糖尿病急症,轻者仅表现为糖尿病酮症,而血pH值正常;严重者出现意识障碍,发生糖尿病酮症酸中毒昏迷。酮体包括β羟丁酸、乙酰乙酸和丙酮,为酸性代谢产物。糖尿病病情严重时,胰岛素缺乏,机体不能有效利用葡萄糖,脂肪代偿分解增加以供给机体所需能量,脂肪酸在肝经β氧化产生大量乙酰辅酶A。由于糖代谢紊乱,草酰乙酸不足,乙酰辅酶A不能进入三羧酸循环氧化供能而缩合成酮体。
【诱因】
T1DM患者由于胰岛素绝对缺乏,有自发酮症倾向,可以以酮症酸中毒昏迷起病。T2DM患者在一定诱因作用下也可发生酮症。常见诱因有感染、胰岛素治疗中断或不适当减量、饮食不当、各种应激,有时无明显诱因。
【病理生理】
(一)酸中毒
各种酸性代谢产物的增加使血pH值降低,导致低体温、心肌收缩力降低和外周循环障碍。当血pH降至7.2以下时,刺激呼吸中枢引起呼吸加深加快;低至7.1~7.0时,可抑制呼吸中枢和中枢神经功能。
(二)严重失水
高血糖和各种酸性代谢产物引起渗透性利尿,酸中毒引起的呼吸加深加快带走大量水分,厌食使水分摄入减少、恶心、呕吐及感染性发热导致进一步失水。
(三)电解质平衡紊乱
渗透性利尿同时使钠、钾等电解质大量丢失,厌食使电解质摄入减少、恶心、呕吐进一步丢失电解质,引起缺钾等电解质代谢紊乱。在酸中毒尚未纠正时,由于血pH降低以及胰岛素绝对缺乏,K+从细胞内转移至细胞外,加之失水导致血液浓缩、血钾浓度可正常甚或增高。随着治疗中胰岛素的补充、酸中毒的纠正、血容量增加,可出现严重低血钾,诱发心律失常,甚至心脏骤停。
(四)携带氧系统失常
酸中毒时,血红蛋白与氧亲和力减弱,血氧离解曲线右移,释放氧增加,起代偿作用。如果过快纠正酸中毒,机体失去这一代偿作用,组织缺氧加重,严重时引起脑水肿。
(五)周围循环衰竭和肾障碍
严重失水和血容量减少持续存在可导致肾灌注量减少,出现少尿或无尿,严重者发生急性肾衰竭,还可发生低血容量性休克。
(六)中枢神经功能障碍
严重酸中毒和可导致脑血流不足及水肿、中枢神经功能障碍。过快纠正酸中毒可能导致脑水肿,血糖下降过快可能加重中枢神经功能障碍。
【临床表现】
在感染、应激状态等诱因下,患者表现为多饮、多尿、口渴等症状加重。之后出现恶心、呕吐,多尿、口干、头痛、嗜睡,呼吸深快,呼气中有烂苹果味(丙酮);后期严重失水,尿量减少、眼眠下陷、皮肤黏膜干燥,血压下降、心率加快,四肢厥冷;晚期有不同程度的意识障碍,反射迟钝、消失,昏迷。少数患者表现以腹痛起病,需与其他原因的腹痛进行鉴别。
【实验室检查】
(一)尿
尿糖强阳性,尿酮体阳性。
(二)血
血糖增高,一般为16.7~33.3mmol/L(300~600mg/dl)。血β-羟丁酸升高,血HCO3-降低,CO2结合力降低。酸中毒失代偿后血气分析显示血pH下降。血钾可以正常、降低或偏高,治疗后若补钾不足可显著降低。血钠、血氯降低,血尿素氮偏高。血浆渗透压轻度上升。即使无合并感染,也可出现白细胞数及中性粒细胞比例升高。
【诊断与鉴别诊断】
对于原因不明的恶心、呕吐、酸中毒、失水、休克、昏迷的患者,不论有无糖尿病病史,均应想到本病的可能性。应询问相关病史和糖尿病常见的临床表现,同时检查毛细血管血糖、尿糖、尿酮查静脉血浆血糖、血β-羟丁酸、尿素氮、肌酐、电解质、血气分析等明确诊断。鉴别诊断包括:①其他类型糖尿病昏迷:低血糖昏迷、高血糖高渗状态、乳酸性酸中毒。②其他疾病所致昏迷:尿毒症、肝性脑病、脑卒中等。
【治疗】
积极治疗糖尿病,消除酮症酸中毒诱因,是主要的预防措施。
对于仅有酮症的患者,如无明显胃肠道反应,可给予胰岛素及口服补充液体,根据血糖水平整胰岛素治疗,酮体逐渐消失;对酮症酸中毒患者应立即抢救,根据临床情况和末梢血糖、尿糖、尿酮测定作出初步诊断后即开始治疗,治疗前需抽取静脉血送生化检测血糖、血电解质、β-羟丁酸等。
治疗原则:尽快补液以恢复血容量,补充胰岛素降低血糖,纠正电解质及酸碱平衡失调,寻找和消除诱因,防治并发症,降低病死率。
(一)补液
通常使用生理盐水。DKA失水量可达体重10%以上,根据患者体重和失水程度估计失水量,开始时输液速度较快,在1~2小时内输入0.9%氯化钠1 000~2 000ml,前4小时输入所计算失水量1/3的液体,24小时输液量一般为4 000~6 000ml。如输液仍不能有效升高血压,应输入胶体溶液并采用其他抗休克措施。以后根据血压、心率、每小时尿量、末梢循环情况及有无发热、吐泻等决定输液量和速度。老年患者及有心肾疾病患者必要时监测中心静脉压,一般每4~6小时输液1 000ml。血糖在13.9mmol/L(250mg/dl)以上时采用生理盐水补液,当血糖下降至13.9mmol/L(250mg/dl)时改用5%葡萄糖液,根据血糖情况和血糖下降速度,每2~4g葡萄糖加入1U短效胰岛素。在初始治疗阶段,补液速度快于胰岛素输注速度,补液需另建输液通路进行。
(二)胰岛素治疗
采用小剂量(短效)胰岛素静脉滴注,每小时每公斤体重给予0.1U胰岛素。通常将短效胰岛素加入生理盐水中持续静脉滴注(应另建输液途径),剂量均为每小时每公斤体重0.1U。重症患者应酌情静脉注射首次负荷剂量10~20U胰岛素。血糖下降速度一般以每小时约降低3.9~6.1mmol/L(70~110mg/dl)为宜,每l~2小时复查血糖,过快的血糖下降可能引起低血糖反应。若在补足液量的情况下2小时后血糖下降不明显,提示患者对胰岛素敏感性较低,胰岛素剂量应增加。当血糖降至13.9mmo1/L时开始输入5%葡萄糖溶液,并按比例加入胰岛素,此时仍需每2~3小时复查血糖,调节输液中胰岛素的比例。只有在碳水化合物保证能量供给的条件下,脂肪分解才能得到抑制,因此在治疗过程中应注意碳水化合物的补充,鼓励患者进食,餐前皮下注射短效胰岛素,由于胃肠道反应不能进食者根据血糖水平增加静脉葡萄糖输入量。
(三)纠正电解质及酸碱平衡失调
多数患者经输液和胰岛素治疗后,酮体水平下降,酸中毒纠正,一般不必补碱。但严重的酸中毒影响多器官功能,危及生命,应给予相应治疗,补碱指征为血pH<7.1,HCO3-<5mmol/L。应采用等渗碳酸氢钠(1.25%~1.4%)溶液。将5%碳酸氢钠84ml加注射用水至300ml配成1. 4%等渗溶液,一般仅给1~2次。过多过快补碱可造成组织缺氧加重、低钾血症、脑水肿等。
DKA患者失钾总量可达300~1 000mmol。由于酸中毒、血容量减少和胰岛素缺乏,治疗前的血钾水平不能真实反映体内缺钾程度,补钾应根据血钾、尿量和肾功能:治疗前血钾低于正常,立即开始补钾,前2~4小时通过静脉输液每小时补钾约13~20mmol/L(相当于氯化钾1. 0~1.5g);血钾正常、尿量>40ml/h,也立即开始补钾;血钾正常、尿量<30ml/h,暂缓补钾,待尿量增加后再开始补钾;血钾高于正常,暂缓补钾并密切监测血钾。头24小时内可补氯化钾达6~8g或以上,加入静脉输液补钾(每500ml液体加入1.5g氯化钾)与口服补钾结合。根据血钾水平和尿量调整补钾量。病情恢复后仍应继续口服钾盐数天。
(四)处理诱因和防治并发症
在抢救过程中同时治疗感染等诱因,预防心、脑、肾等脏器功能衰竭。
1.休克 严重的休克治疗后不能纠正者,应注意有无感染等伴发病并给予相应治疗。
2.严重感染 是本病常见诱因。因DKA可引起低体温和血白细胞数升高,故不能以有无发热或血象改变来判断,应积极查找和处理感染因素。
3.心力衰竭 补液过多可导致心力衰竭和肺水肿,应注意预防。可根据血压、心率、尿量等调整输液量和速度。血钾过低、过高均可引起严重心律失常,宜用心电图监护,及时治疗。
4.肾衰竭 治疗过程中应密切监测尿量和肾功能变化,及时处理肾血流灌注不足。
5.脑水肿 脑水肿常与脑缺氧、补碱不当、补液速度过快和血糖下降过快等有关。如经治疗后,血糖有所下降,酸中毒改善,但昏迷反而加重,或虽然一度清醒,但烦躁、心率快、血压偏高、肌张力增高,应考虑脑水肿的可能。可给予地塞米松和呋塞米治疗。
(五)护理
应按时清洁口腔、皮肤,预防褥疮和继发性感染。观察病情变化,记录生命体征、神志、出入量等。每1~2小时测血糖,4~6小时复查肌酐、电解质和酸碱平衡指标等。
高血糖高渗状态高血糖高渗状态(hyperglycemic hyperosmolar status,HHS),是糖尿病急性代谢紊乱的另一临床类型,以意识障碍或昏迷、严重高血糖、高血浆渗透压、脱水为特点,无明显酮症酸中毒,部分患者可无昏迷,部分患者可伴有酮症。多见于老年糖尿病患者,原来无糖尿病病史,或仅有轻度症状,用饮食控制或口服降糖药治疗。
常见诱因包括急性感染和各种应激状态,饮食不当,水摄入不足或失水,使用糖皮质激素或利尿剂等。
本病起病缓慢,初期表现为多尿、多饮,可伴有食欲减退。之后逐渐出现严重脱水和神经精神症状,患者反应迟钝、烦躁或淡漠、嗜睡,逐渐出现昏迷、抽搐,晚期尿少甚至无尿。就诊时呈严重脱水、休克,可有神经系统损害的定位体征。与DKA相比,失水更为严重、神经精神症状更为突出。
实验室检查:血糖达到或超过33.3mmol/L(一般为33.3~66.8mmol/L),有效血浆渗透压[2×(Na++K+)(mmol/L)+血糖(mmol/L)]达到或超过320mOsm/L(一般为320~430mOsm/L)。血钠正常或增高,尿酮体阴性或弱阳性,一般无明显酸中毒,可与DKA鉴别,但二者亦可同时存在。
临床上遇有原因不明的脱水、休克、意识障碍及昏迷均应想到本病可能性,尤其是血压低而尿量多者,不论有无糖尿病史,均应进行有关检查以肯定或排除本病。治疗原则同DKA。本症失水比DKA更为严重,可达体重10%~15%,输液要更为积极小心,24小时补液量可达6000~10000ml。目前多主张治疗开始时用等渗溶液如0.9%氯化钠。休克患者应另予以血浆或全血。如无休克或休克已纠正,在输入生理盐水后血浆渗透压高于350mOsm/L,血钠高于155mmol/L,可考虑输入适量低渗溶液如0.45%或0.6%氯化钠。视病情可考虑同时给予胃肠道补液。当血糖下降至16.7mmol/L时开始输入5%葡萄糖液并按每2~4g葡萄糖加入1U胰岛素。胰岛素治疗方法与DKA相似,以每小时每公斤体重0.1U的速率静脉滴注胰岛素。注意补钾,一般不补碱。处理诱因、防治并发症和护理均与DKA相同。






